品質管理に関する開示
改正薬機法における
組織体制について
改正薬機法(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律(2019年法律第63号))における 2021年8月1日施行の法令遵守組織体制を以下のとおり、お知らせいたします。
<責任役員※>
| 岩本 紳吾 | 代表取締役社長 |
|---|
※責任役員…薬事に関する業務に責任を有する役員
<総括製造販売責任者>
| 平尾 武士 | 信頼性保証本部 本部長 |
|---|
<品質保証責任者>
| 横田 聡司 | 信頼性保証本部 品質保証部長 |
|---|
<安全管理責任者>
| 高瀬 宏樹 | 信頼性保証本部 安全管理部 安全性評価グループ マネージャー |
|---|
後発医薬品の製造販売承認書と
実態の整合性に係る点検の実施状況
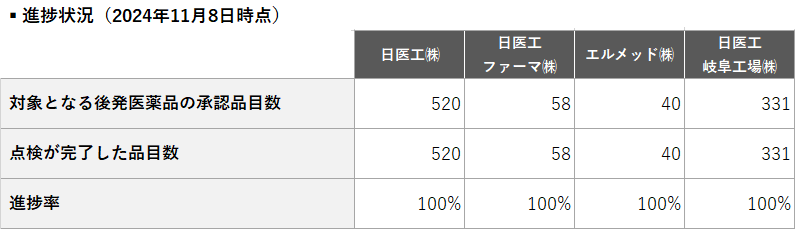
日医工グループは、令和6年4月5日に発出されました「後発医薬品の製造販売承認書と製造方法及び試験方法の実態の整合性に係る点検の実施について」(医政産情企発0405第1号 、医薬薬審発0405第8号、医薬監麻発0405第1号)に基づき、製造販売承認書と製造方法及び試験方法の実態の整合性に係る自主点検を実施しております。
点検スケジュール及び進捗状況について、以下の通りご報告いたします。