安心と信頼への取り組み
安心と信頼への約束

品質向上への取り組み
日医工グループは、医薬品品質システムの構築ならびにQuality Cultureの醸成(品質を重要視する企業文化の醸成)を目的として、以下の取り組みを行っております。
安心と信頼への約束
(日医工グループ品質方針)の策定
2020年7月15日に、日医工グループ品質方針を策定いたしました。
医薬に携わる者として、倫理、道徳を踏まえて法令を遵守すること、そして品質の維持向上にこだわりを持ち、確かな品質の医薬品をお届けする企業姿勢を、5つの品質行動指針にまとめました。全従業員が、会議、朝礼の場で、5つの品質行動指針の読み合わせを行い、品質第一の認識を日々新たにする活動を行っております。
また、各部門で品質方針の取り組みの具体的な施策を策定し、経営会議で進捗を毎月報告する活動も行っております。
5つの品質行動指針すべての主語が、「私は」で始まります。社員一人一人が、品質向上の当事者であり、GMPを遵守し、信頼ある医薬品を提供していくためには、品質向上が全て自分たちの問題であるという強い決意を表しております。
教育の徹底
- 従業員から役員までを対象としたGMP教育を継続的に行っており、役員を含め、GMP基礎知識とGMP遵守に関する試験を実施し、2千名を超える対象者すべての受験を完了しております。
- 薬機法と企業倫理についての教育や、薬機法・GMP省令への違反事例等の研修も実施しています。
- 実際に製造管理、品質管理で使用する手順書・SOP等を改訂する際には、その都度、対象となる従業員に対し教育および訓練を実施し、手順書の遵守と記録の作成を定着させてきました。また、GMPの責任者と担当者といった階層や業務のレベルに合わせて、理解しやすい内容で教育を実施しています。
- 教育内容とともに教育時間の確保も重要と捉えております。現在製造並びに品質管理部門の職員には一人当たりの就業時間の5%を教育時間に充てることを目標に教育計画を策定しております。
経営資源の適正配分
適正な経営資源を品質強化および生産性向上のために配分することにより、日医工グループは新たな品質方針に沿って、全社員が一丸となり患者様の病気と気持ちに寄り添う「安心と信頼」の医薬品をお届けし続けてまいります。
(主な設備投資について)
当社グループの品質管理体制を強化し、生産性を向上させることを目的に、当社工場における品質管理関連設備及び生産性向上に向けた製造設備投資※1のための資金として、2021 年9月から 2022 年4月までの期間において22億円を充当する予定です。
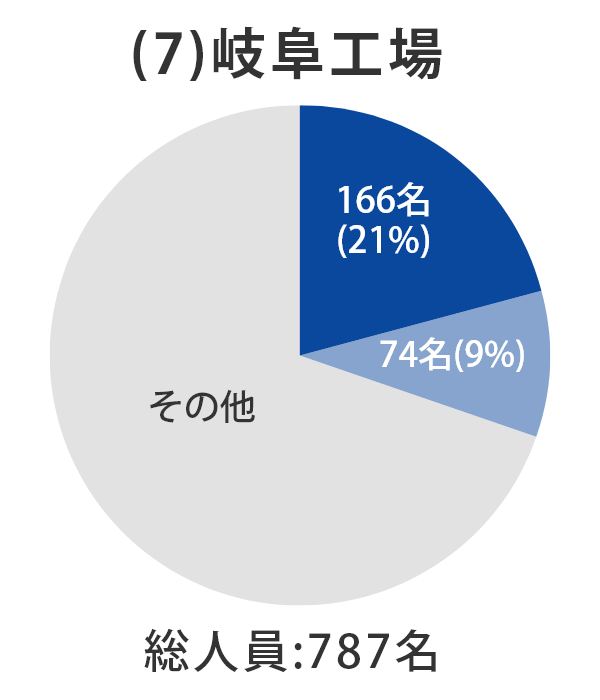
また、同様の目的として、2021 年2月に譲り受けた岐阜工場における品質管理関連設備及び生産性向上に向けた製造設備投資※2のための資金として、2021 年9月から 2023 年3月までの期間において30億円を充当する予定です。
※1原料等の量り違えおよび取り違えを防止する秤量システム、品質試験を効率的に行うための全自動溶出試験機用モニタリングシステム、出荷時の不良品検出精度を向上させる X 線検査機など。
※2顆粒剤・注射剤検査機の最新機種への切り替え、試験能力を向上させるための安定性試験器、自動化包装ラインの導入など。
組織体制
- 2018年10月1日付で、品質管理本部を生産本部から移管させ、品質管理業務とGMP遵守に独立性を持たせた組織を新設しております。
-
2020年4月1日付で、社長直属の組織としてGMP監査室を設置いたしました。逸脱の監視を行うと同時に、正しくGMPの記録が作成されているかどうかを確認し、現場を指導する役目を担っております。
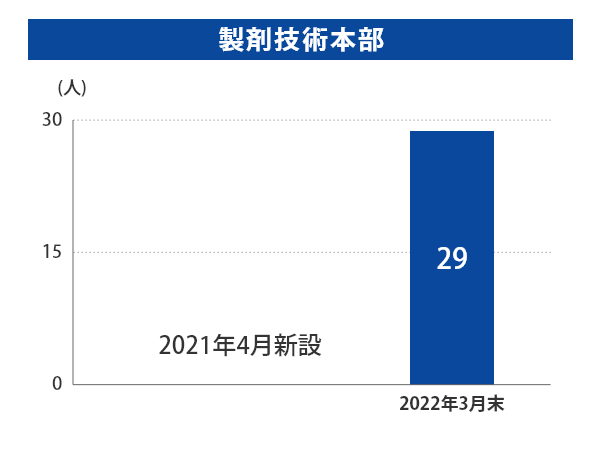
(2022年1月1日付けでGMP監査室の業務は、信頼性保証本部に移管されております。) - 2021年4月1日付で、既存品が抱えている課題の早期解決と重複品目の統合および製造場所の検討を行い、保有する各工場の生産機能の最適化および品質維持を目的とした体制強化として、製剤技術本部を新設いたしました。
- 2021年4月16日付で、医薬品製造販売業の三役の権限を明確化するため、総括製造販売責任者を本部から独立させて、社長直下の位置付けとしました。
- 2021年4月16日付で、品質管理本部に所属する医薬品製造管理者の権限を強化するために、人事規定を改定し、各工場の工場長と同格の部長クラスとすることを盛り込みました。さらに、医薬品製造管理者から直接、経営陣に報告することを義務化いたしました。
- 2021年8月10日付けで、当社ホームページにおいて、製造販売業における三役・製造管理者・工場長に関する情報公開を開始しました。
- 2022年1月1日付けで、品質保証部配下に『監査グループ』を新設しました。自社製造所、委託製造所、原薬製造所のGMP調査および規制当局のGMP適合性調査に加え、GMP監査室の業務も移管し、業務の効率化と監査計画の進捗を加速させGQP管理強化させております。
適正人員による製造の実現
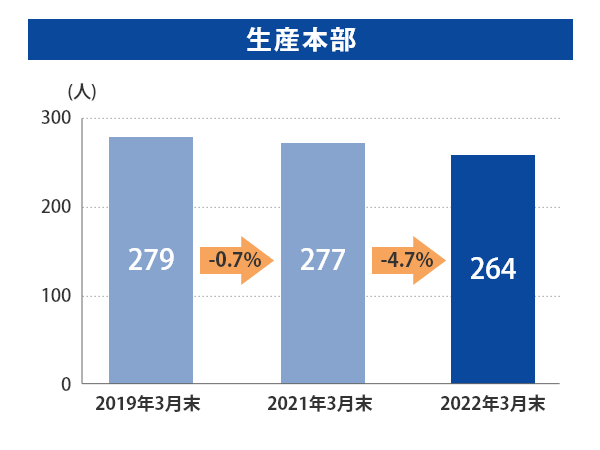
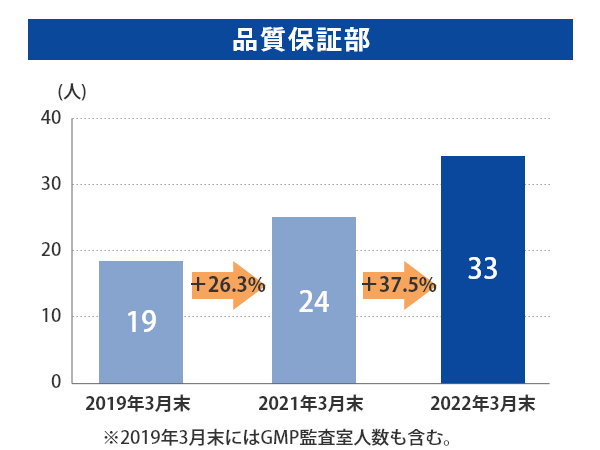
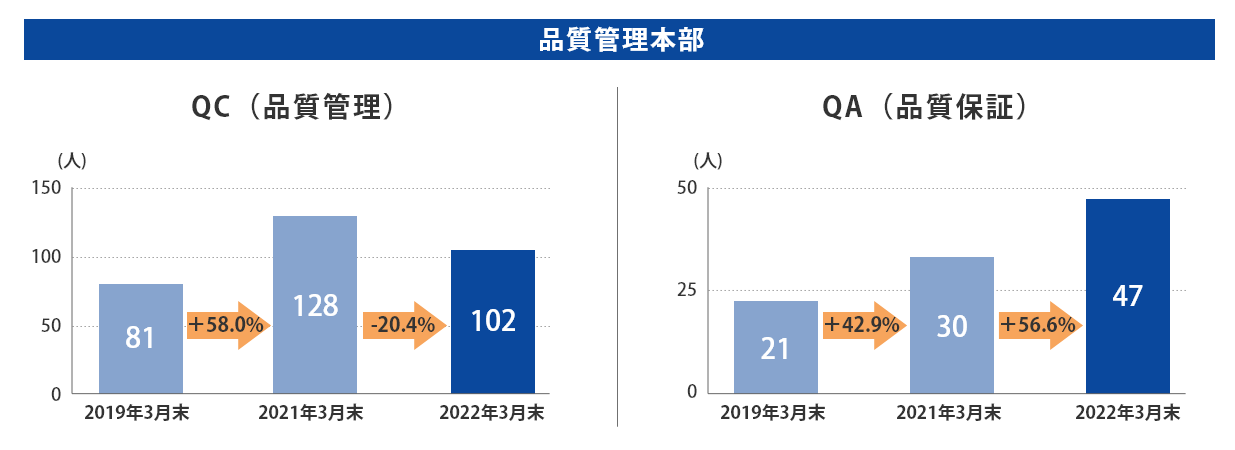
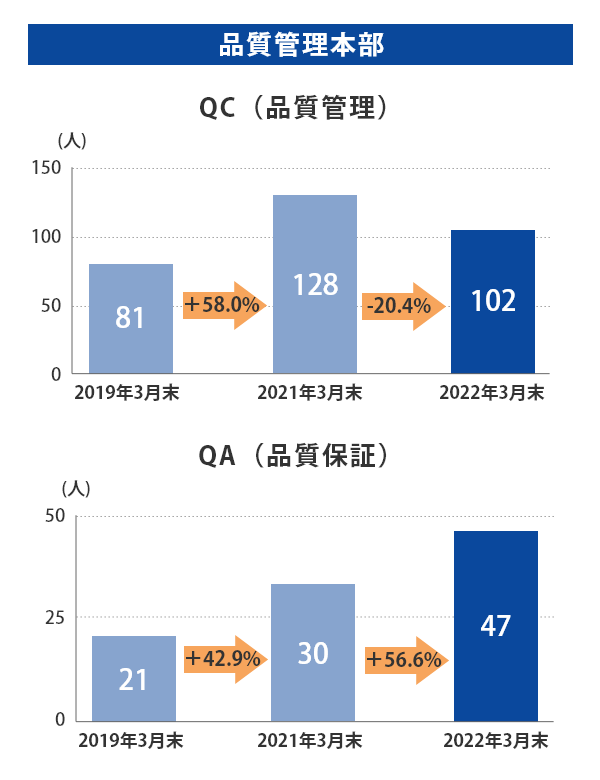
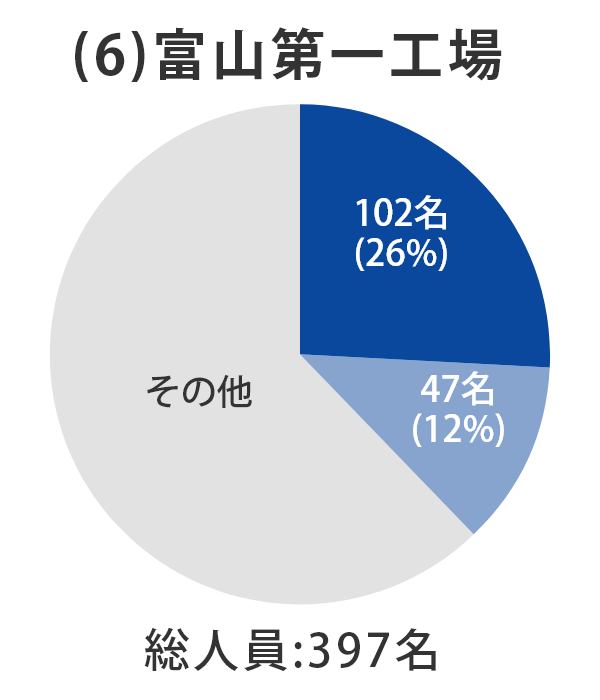
富山第一工場では2019年3月末から2022年3月末にかけて、製造部門の人数はほぼ横ばいである一方、QCは+25.9%、QAは+123.8%、品質保証部(GMP監査室含む)は+74%と大幅に増員しております。
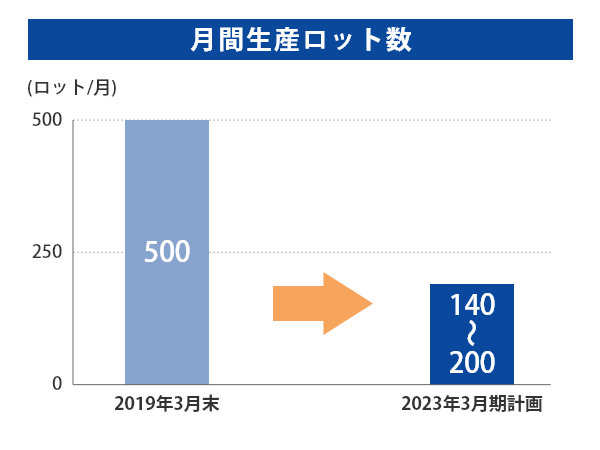
さらに富山第一工場の月間生産ロット数を約500ロット(2019年3月期 最大時)から140~200ロット(2023年3月期計画)に抑えることで、確かな製造管理・品質管理を実現してまいります。
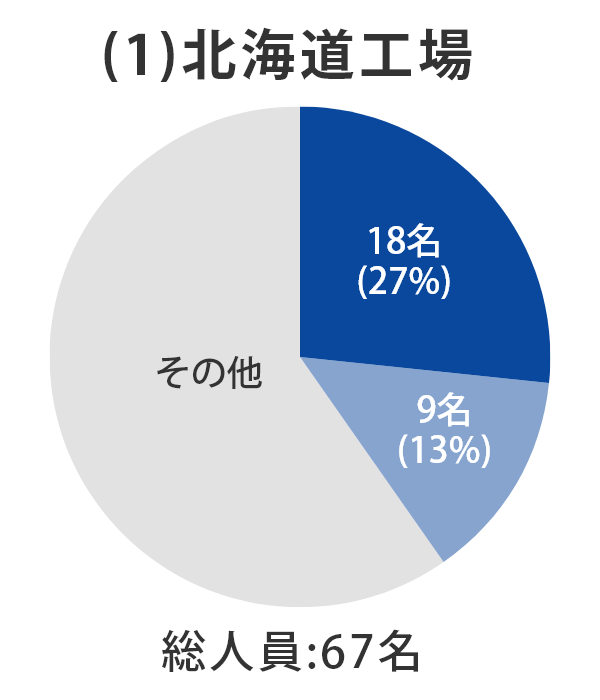
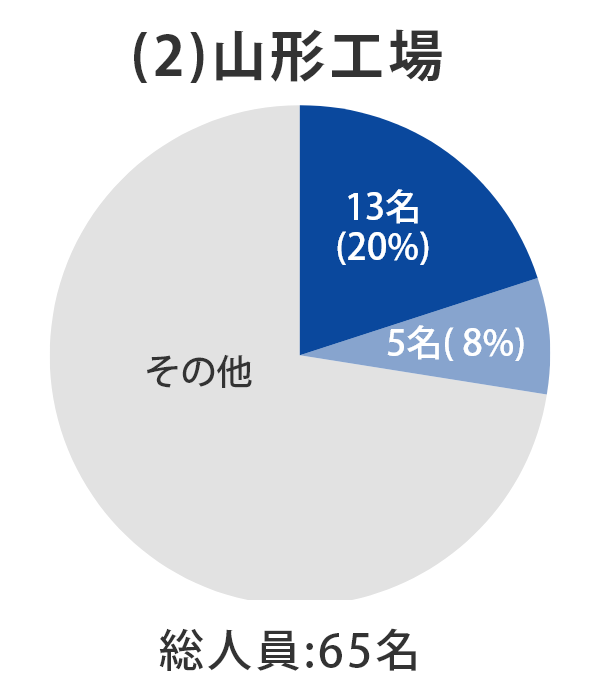
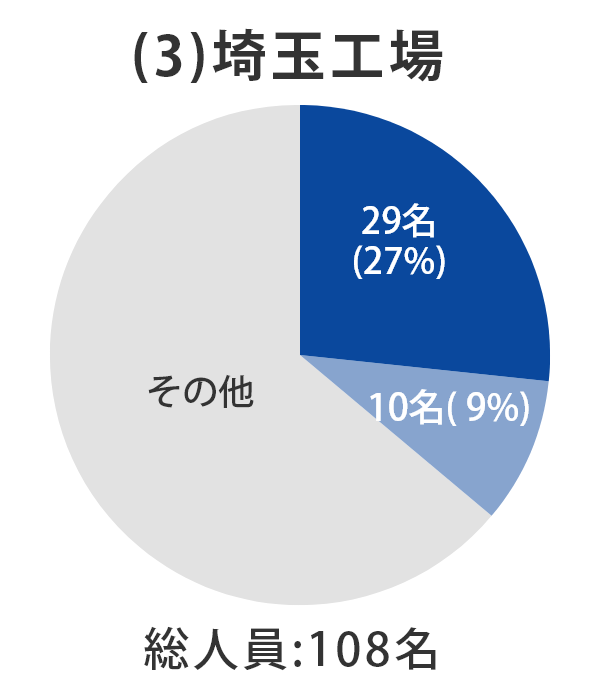
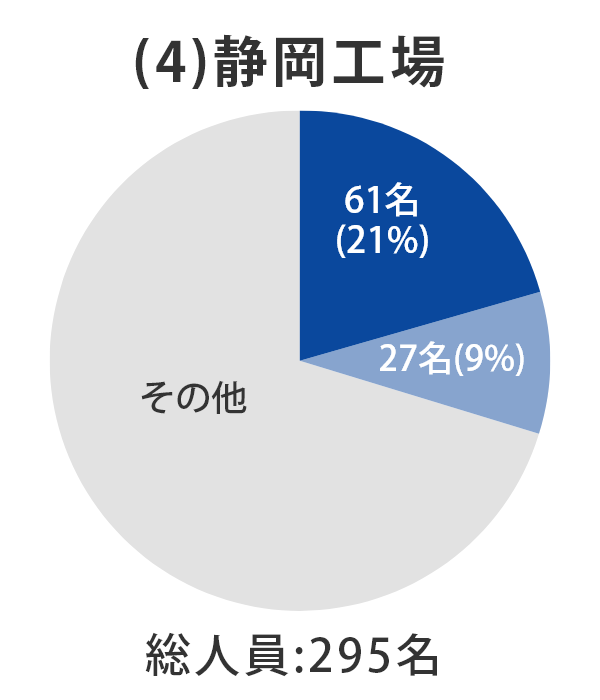
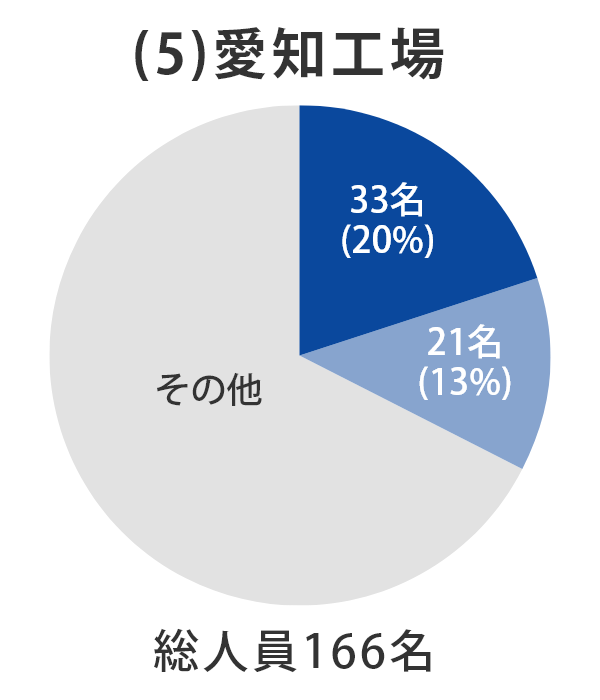
当社グループ7工場の各事業所における総人員数に占める品質部門の人員比率については、以下のとおりとなっております。 日本製薬団体連合会※は、参考値として「QC部門の人員比率20%以上、QA部門の人員比率を5%以上」の人員配置の検討を求めており、2022年3月末時点では、それらを上回る割合で適正配置されており、各事業所における適正な品質管理および品質保証の業務が行われております。
製造管理システム、
品質管理システムの導入・運用
- 製造管理システム
製造工程の機器から人を介さずに直接運転パラメータを取得するシステム(SCADA)を2021年8月に導入、9月より製剤各工程の代表設備20台について運用を開始いたしました。常時設備の運転状況をモニタリングすることにより異常を早期発見でき、大きなトラブルを未然に防ぐことが出来ております。また、運転記録が残ることから、人によるミスの確認が容易に出来るとともに製造指図内容と異なった作業をさせないための管理体制となっております。なお、今後機器の接続台数を計画的に拡大していきます。
このSCADAと連動する製造実行システム(MES)を2023年目処に導入を計画しております。MESは作業の指図を行い、製造状態の把握をして管理をする一連のシステムです。これらを将来的に連動させることにより、人の介在、データの改ざん等が行われないよう確かな製造管理、品質管理を実現してまいります。なお、グループ工場である岐阜工場ではSCADA、MESの運用を行っております。 - 品質管理システム
品質管理システム(LIMS)を既に導入しております。このシステムによって改ざん不可でかつ欠損や不整合の無いデータを確保できます。また、試験実施毎にオーディットトレイル(監査証跡)を行ってデータの信頼性を保証する手法も取り入れています。品質管理システムについては、日医工全工場で運用を行っております。
GMP監査体制の強化(社内、社外)
-
社外監査として、外部GMPコンサルタント(NPO法人NPO-QAセンター様)による2023年3月期実績は、以下のとおりです。
2023年3月期の社外監査として、外部GMPコンサルタント(NPO法人NPO-QAセンター)による監査を実施しました。また、監査において信頼性保証本部の監査員のスキルアップを図るため、日医工の監査員が同行し共同で実施いたしました。<2023年3月期実績>
工場名 埼玉 富山第一 静岡 ヤクハン 山形 愛知 実施年月 2022年
4月2022年
5月2022年
7月2022年
7月2022年
9月2022年
10月 -
2024年度3月期におきましては、日医工として自立したチェック体制を構築するために、日医工の監査員が主体となって行うグループ工場監査に対し、外部GMPコンサルタントに同行いただき、GQP監査に対する指導をいただくことを計画しております。2024年度3月期計画は、以下のとおりです。
<2024年3月期計画>
工場名 埼玉 静岡 ヤクハン 山形 愛知 富山第一 実施年月 2023年
5月2023年
7月2023年
9月2023年
10月2024年
1月2024年
2月富山第一工場につきましては、GMPシステムの改善が認められたこと、他工場同様、年1回の確認を行います。
品質リスクマネジメント
富山第一工場で製造している製品について、FMEA等による品質リスク評価を実施し、品質リスクが無いことが確認できた製品について、製造着手および出荷を行っております。
リスク評価については、今後も継続的に実施するとともに、リスク評価で得られた知見を製品の品質管理にフィードバックすることで、より安心して服用いただけるお薬を提供してまいります。
各手順書類の内容見直しと明確化
試験の結果が規格外となった際の適切な処理方法について規定した規格外試験検査結果(OOS)管理手順書、製造管理や品質管理業務で基準や手順から外れた際に適切に処理するための逸脱管理手順書、等々の重要な手順書の内容を精査しました。
OOSや逸脱の処理に際し、誰が読んでも理解して実行できるよう、一目でわかる処理手順図を挿入し、表現方法についても見直しました。これらも含めて各手順書類については、改善と改訂を継続して実施しており、間違いや誤解を防ぐ手順書の制定に注力しています。
記録書類の見直し
製造指図記録書および試験記録書についても、作業者の間違いや誤解を防ぐことや、記録の完全化を図ることを目的として、作業手順と試験手順を見直した上で、それらの記録書類もすべて更新を図りました。
この更新業務には製造現場の担当者、試験の担当者が参加し、作成された記録書類は品質保証(QA)部門によって照査、承認を行った上で、使用しています。
出荷判定の強化
製造管理、品質管理が適切に実施されていることを、製造記録書、試験記録書および逸脱、OOS、変更管理等の記録にて、詳細に確認しています。この確認作業にかかる人員を大幅に増強し、記録の完全性のチェック体制を厚くした上で、出荷判定会議にて最終確認を行います。その上で問題ないものについて、工場からの出荷判定、市場への出荷判定というチェック過程を通過した製品を出荷しています。
富山第一工場からの出荷状況週次更新
当社医療機関社向け専用サイトにおいて、富山第一工場の出荷調整および欠品見込み対象製品について、出荷時期の情報を週次で更新しております。
内部通報制度
法令違反等の不適切な行為の未然防止や早期発見を目的に、役員および社員などが直接相談・通報できる窓口として、社内(コンプライアンス推進室)および社外(弁護士事務所)に内部通報窓口を設置するとともに、内部通報制度の社員向け教育や周知徹底を図っております。
また、「安心と信頼への約束≪日医工グループ品質方針≫」の下、2021年1月にはコンプライアンス推進室に、薬機法令と実務に詳しく製造管理者・総括製造販売責任者を経験した者を新たに配置し、GMP(医薬品等の製造管理および品質管理の基準)に関する専用の内部通報窓口も設置しております。
2021年11月5日には、消費者庁所管の「内部通報制度認証(自己適合宣言登録制度)※」の登録事業者として登録されました。