医療関係業者向けサイト
臨床試験国内第Ⅲ相試験 安全性
国内第Ⅲ相試験 安全性
1. 投与24週までの安全性(ステージA)
ステージAにおける有害事象注1)は,本剤群で55.5%(146/263例),先行バイオ医薬品注2)群で65.7%(167/254例)に認められ,副作用は,本剤群で22.1%(58/263例),先行バイオ医薬品注2)群で36.2%(92/254例)に認められた。重篤な副作用は,本剤群で1.5%(4/263例),先行バイオ医薬品注2)群で0.4%(1/254例)であり,その内訳は本剤群では肺炎,ニューモシスチス・イロベチイ肺炎,大腸菌性尿路感染,成人発症スチル病が各1例に認められ,先行バイオ医薬品注2)群では肺炎が1例に認められた。副作用による投与中止例は,本剤群では成人発症スチル病が1例に認められ,先行バイオ医薬品注2)群では発疹,蕁麻疹,注射部位反応,局所反応が各1例に認められた。
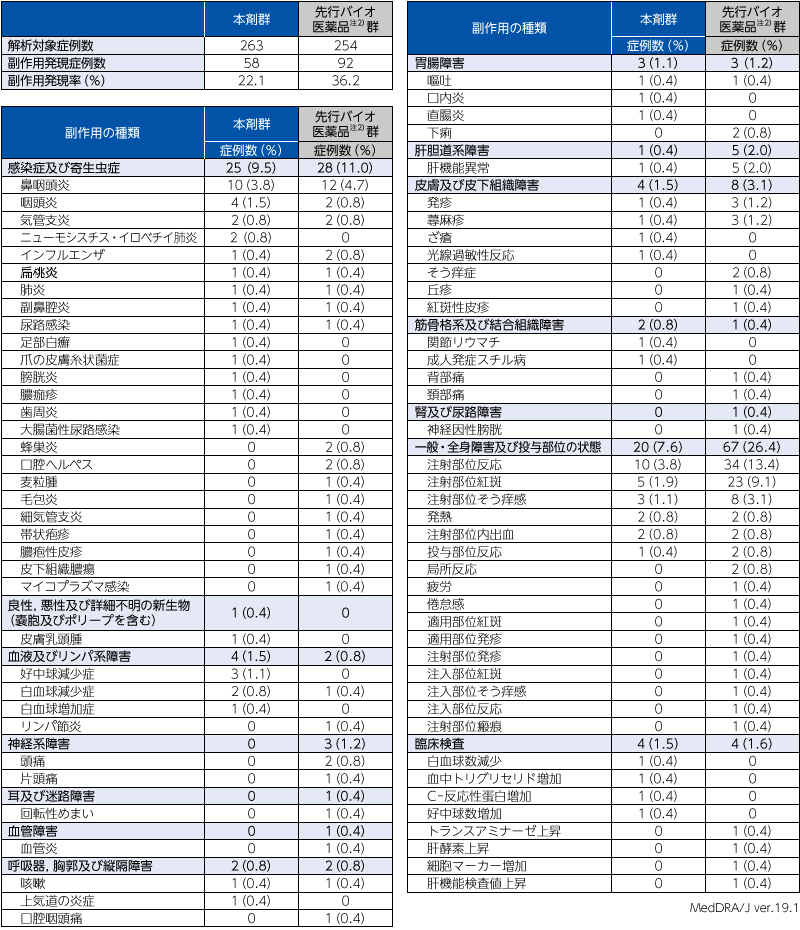
- 注1)有害事象のうち,治験薬を少なくとも1回投与した後に,新規に発現した事象又は既存の状態の重症度が悪化したもの。
- 注2)先行バイオ医薬品:Enbrel®(欧州で承認されたエタネルセプト(遺伝子組換え)製剤)
2. 投与24~52週までの安全性(ステージB)
ステージBにおける有害事象注1)は本剤継続群で52.8%(124/235例),先行バイオ医薬品注2)継続群で63.3%(145/229例),副作用は本剤継続群で11.9%(28/235例),先行バイオ医薬品注2)継続群で27.1%(62/229例)であった。重篤な副作用は,本剤継続群で1.7%(4/235例),先行バイオ医薬品注2)継続群で0.4%(1/229例)であり,その内訳は本剤継続群では鼻炎,副鼻腔炎,細菌性肺炎,間質性肺疾患,胸膜嚢胞が各1例に認められ,先行バイオ医薬品注2)継続群では帯状疱疹が1例に認められた。副作用による投与中止例は,本剤継続群では直腸周囲膿瘍,間質性肺疾患が各1例に認められたが,先行バイオ医薬品注2)継続群では認められなかった。
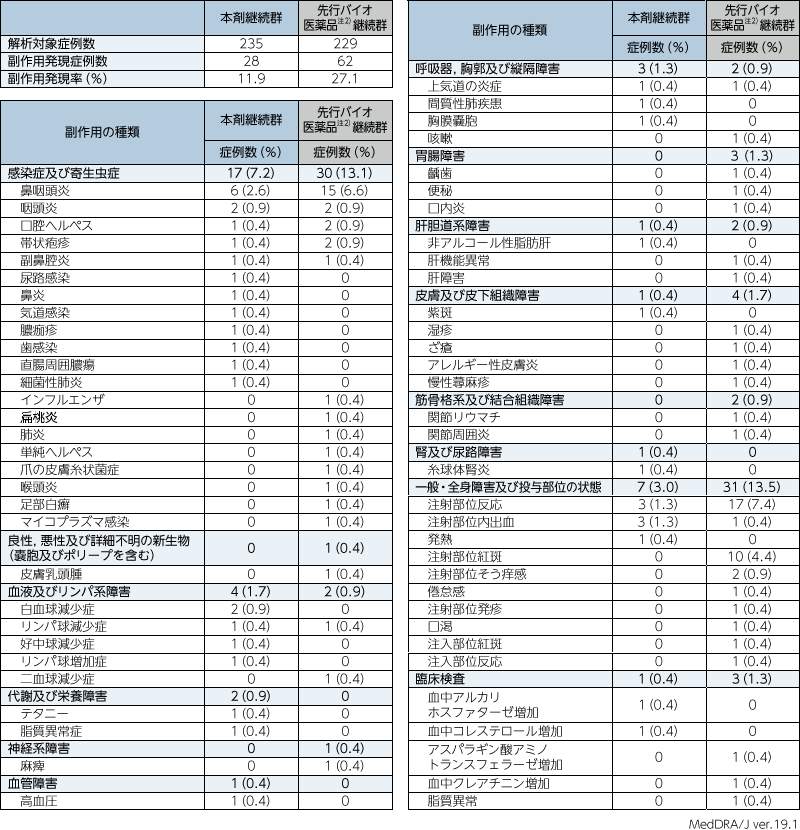
- 注1)有害事象のうち,治験薬を少なくとも1回投与した後に,新規に発現した事象又は既存の状態の重症度が悪化したもの。
- 注2)先行バイオ医薬品:Enbrel®(欧州で承認されたエタネルセプト(遺伝子組換え)製剤)
3. 投与24~52週までの安全性(ステージC)
ステージCにおける有害事象注1)は先行バイオ医薬品注2)→本剤群で30.0%(3/10例),本剤→先行バイオ医薬品注2)群で37.5%(3/8例),副作用は先行バイオ医薬品注2)→本剤群で10.0%(1/10例),本剤→先行バイオ医薬品注2)群で25.0%(2/8例)であった。その内訳は先行バイオ医薬品注2)→本剤群で好中球減少症が1例,本剤→先行バイオ医薬品注2)群で好中球減少症,白血球減少症,注射部位紅斑が各1例であった。重篤な副作用又は副作用による投与中止例は,いずれも両群で認められなかった。
- 注1)有害事象のうち,治験薬を少なくとも1回投与した後に,新規に発現した事象又は既存の状態の重症度が悪化したもの。
- 注2)先行バイオ医薬品:Enbrel®(欧州で承認されたエタネルセプト(遺伝子組換え)製剤)



