日医工の
「ジェネリック医薬品が
できるまで」
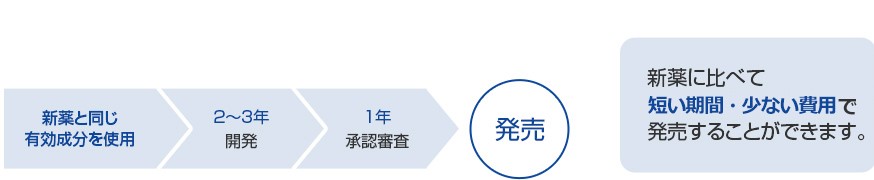
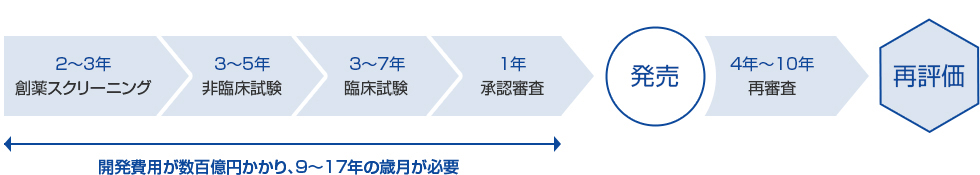
ジェネリック医薬品は先発医薬品に比べて短い開発期間及び少ない開発費用で発売することができますが、発売に至るまでには下記に示す多くのプロセスを経る必要があります。
●先発医薬品
Step1 特許調査、開発品目選定

Step2 原薬選定、製剤化検討、治験薬製造

Step3 分析方法検討、安定性試験、生物学的同等性試験(溶出試験)

Step4 生物学的同等性試験(ヒトBE試験)

Step5 工業化検討

信頼性確保(申請資料の監査)