よくあるご質問
よくお寄せいただくご質問にお答えします。
製品名アクプラ静注用
-
外箱開封後に直射日光を避ける理由は?
アクプラが、光に不安定なためです。
製剤の苛酷試験(25℃・白色光 5000Lx、ガラスバイアル)において、溶状が5日で微黄褐色澄明へ変化し、含量は規格外でした。
また、性状は10日で微黄色の軽質の塊でした。*1)
※開始時の溶状:微黄色澄明
※開始時の性状:微黄白色の軽質の塊
参考資料
*1)アクプラ静注用 インタビューフォーム
[改訂 2025年5月]
-
投与後に、引き続き1000mL以上の輸液を点滴静注する理由は?
輸液投与にて尿量を確保し、腎毒性を軽減するためです。
水分負荷(hydration)を行うことにより尿中のアクプラの濃度を下げ、尿細管障害を防御します。
[更新 2025年5月]
-
腎機能障害のある患者に投与する際には、どのような注意が必要ですか?
アクプラ静注用は、重篤な腎障害のある患者への投与は禁忌であり、腎機能障害患者は腎障害が増悪するおそれがあるため注意が必要です。*1)
なお、腎障害患者を対象とした臨床試験は行っていません。
日本腎臓病薬物療法学会の「腎機能低下時に最も注意が必要な薬剤投与量一覧」では、CCr30~60mL/minでは、開始用量1日1回80mg/m2(EO:専門家の意見)(CCr<60mL/minで、100mg/m2で投与された患者では血小板減少などの有害事象が多い)
CCr30mL/minより低い場合と透析患者では禁忌(重篤な腎障害のある患者、腎障害が増悪する)
との記載があります。*2)
参考資料
*1) アクプラ静注用 添付文書
*2) 日本腎臓病薬物療法学会、腎機能低下時に最も注意が必要な薬剤投与量一覧,2024年4月1日改訂(37版)
[作成 2025年5月]
製品名アミカシン硫酸塩
-
点滴静脈内投与時の液量設定の理由は?
アミカシンの点滴静脈内投与時の液量は、30分~1時間の点滴時間を確保するために設定されています。
点滴時間を短くした場合、急激に血中濃度が上がり、副作用の原因となるおそれがあります。*1)
参考資料
*1)アミカシン硫酸塩注射液「日医工」 添付文書
[更新 2024年5月]
製品名エリブリンメシル酸塩静注液1mg「日医工」
-
アルコールに対して過敏症の既往歴がある方に投与できますか?
エリブリンメシル酸塩静注液「日医工」は、 1バイアル2mL中に無水エタノールを0.10mL含有します。
そのため、アルコールに対して過敏症の既往歴がある方に投与することは推奨しておりません。
[作成 2024年12月]
-
他の抗悪性腫瘍剤と併用できますか?
他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していません。
エリブリンメシル酸塩製剤の国内第I、II相試験*1)*2)は、単剤投与で実施されました。
参考資料
*1) ハラヴェン静注 国内第Ⅱ相試験(乳癌):221試験[進行又は再発乳癌を対象とした臨床第Ⅱ相試験(国内試験)
(ハラヴェン静注:2011年4月22日承認、申請資料概要2.7.6.11)]
*2) ハラヴェン静注 国内第Ⅰ相試験(固形がん):105試験[日本人固形がん患者を対象とした臨床第Ⅰ相試験(国内試験)
(ハラヴェン静注:2011年4月22日承認、申請資料概要2.7.6.3)]
[作成 2024年12月]
-
CYP3A4で代謝される薬剤、CYP3A4を誘導もしくは阻害する薬剤と併用する際には、どのような注意が必要ですか?
エリブリンメシル酸塩製剤はCYP3A4で代謝される薬剤に影響を与えず、またCYP3A4を誘導もしくは阻害する薬剤の影響を受けないと考えられるため、それらの薬剤との併用に関しては注意喚起をしていません。
・エリブリンメシル酸塩製剤の試験(in vitro)において、CYP3A4の弱い競合阻害作用を示し、CYP3A4を誘導しないことが確認されています。*1)
・エリブリンメシル酸塩製剤の試験(in vitro)において、主にCYP3A4で代謝されることが確認されていますが*1)、固形がん患者を対象とした試験(in vivo)において生体内ではほとんど代謝されないことが示唆されています(外国人データ)。*2)
・外国人固形がん患者にCYP3A4の強い阻害薬であるケトコナゾールと併用した際*3)及びCYP3A4の強い誘導薬であるリファンピシンと併用した際*4)には、エリブリンメシル酸塩製剤の薬物動態パラメータは影響を受けませんでした。
参考資料
*1) エリブリンメシル酸塩のin vitro代謝(ハラヴェン静注:2011年4月22日承認、申請資料概要2.6.4.5)
*2) 固形がん患者を対象としたマスバランス試験(外国試験)(ハラヴェン静注:2011年4月22日承認、申請資料概要2.7.6.4)
*3) Devriese L. A., et al.:Invest. New Drugs. 2013;31(2):381-389
*4) Devriese L. A., et al.:Br. J. Clin. Pharmacol. 2013;75(2):507-515
[作成 2024年12月]
-
過敏症の発現との関連が考えられているポリオキシエチレンヒマシ油、ポリソルベート80、ポリエチレングリコールを含有していますか?
エリブリンメシル酸塩静注液「日医工」は、ポリオキシエチレンヒマシ油、ポリソルベート80、ポリエチレングリコールを含有していません。
添加物として、無水エタノール、塩酸、水酸化ナトリウムを含有します。
[作成 2024年12月]
-
高齢者に投与する際には、どのような注意が必要ですか?
高齢者は、一般的に生理機能が低下していることが多く、骨髄抑制や消化器症状等の副作用があらわれやすいため注意が必要です。
なお、エリブリンメシル酸塩製剤における国内外の9つの臨床試験の統合解析においては、65歳以上(n=63)と65歳未満(n=206)との間にクリアランスの差は認められませんでした*1)。
参考資料
*1) エリブリンメシル酸塩の母集団薬物動態解析(ハラヴェン静注:2011年4月22日承認、申請資料概要2.7.2.3.2.3)
[作成 2024年12月]
-
腎機能障害のある患者に投与する際には、どのような注意が必要ですか?
腎機能障害のある患者では、エリブリンのAUCが増加する傾向があるため注意が必要です。
外国人固形がん患者19例をクレアチニンクリアランスによって、正常(≧80mL/min)、中等度腎機能障害(30-50mL/min)及び重度腎機能障害(15-29mL/min)に分類し、それぞれエリブリンメシル酸塩製剤(1.4mg/m2、1.4mg/m2及び0.7mg/m2)を投与した際の薬物動態パラメータは以下の通りでした。腎機能の低下に伴い半減期は変化しなかったものの、クリアランスの低下、投与量で補正したAUCの増加及びCmaxの増加が認められました(外国人データ)*1)。
腎機能正常患者及び腎機能障害患者における薬物動態パラメータ*1)
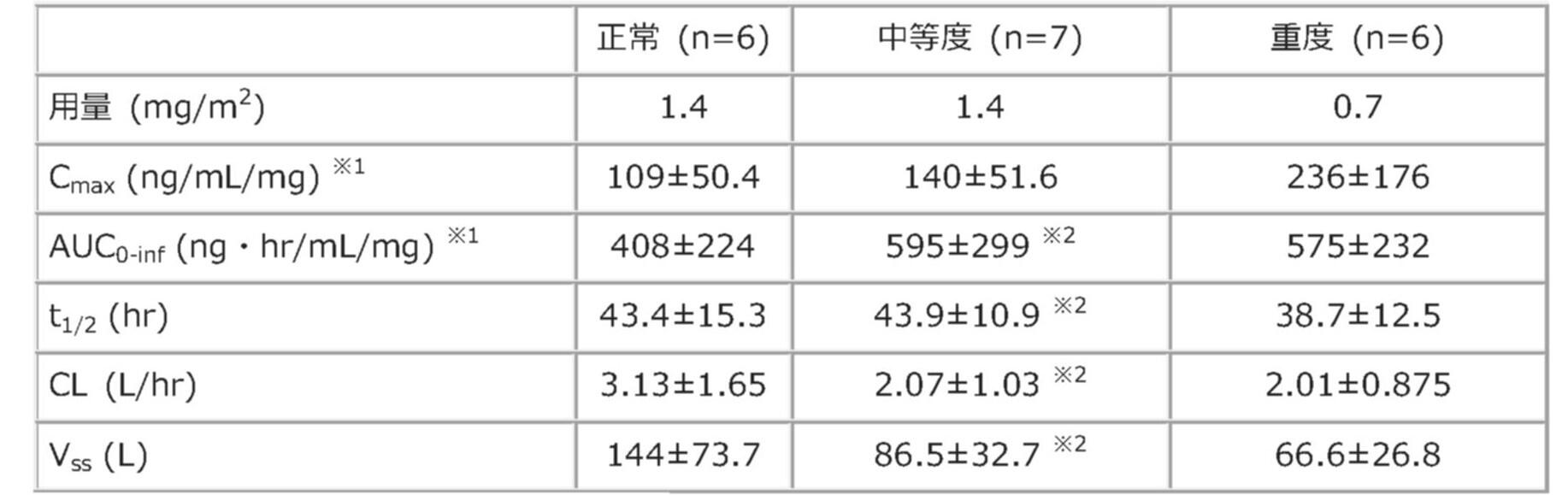
※1 エリブリン1mgあたりに補正した数値
※2 n=6
参考資料
*1) Tan A. R., et al.:Cancer Chemother. Pharmacol. 2015;76(5):1051-1061
[作成 2024年12月]
-
肝機能障害のある患者に投与する際、どのような注意が必要ですか?
肝機能障害のある患者では、エリブリンのAUCが増加し、好中球減少の発現頻度が高くなる傾向があるため、減量を考慮するなどの注意が必要です。
外国人固形がん患者18例をChild-Pugh分類によって、正常、軽度肝機能障害(Child-Pugh A)及び中等度肝機能障害(Child-Pugh B)に分類し、それぞれエリブリンメシル酸塩製剤(1.4mg/m2、1.1mg/m2及び0.7mg/m2)を投与した際の薬物動態パラメータは以下の通りでした。肝機能の低下に伴いクリアランスの低下、半減期の延長、投与量で補正したAUCの増加及びCmaxの増加が認められました(外国人データ)*1)。
肝機能正常患者及び肝機能障害患者における薬物動態パラメータ*1)
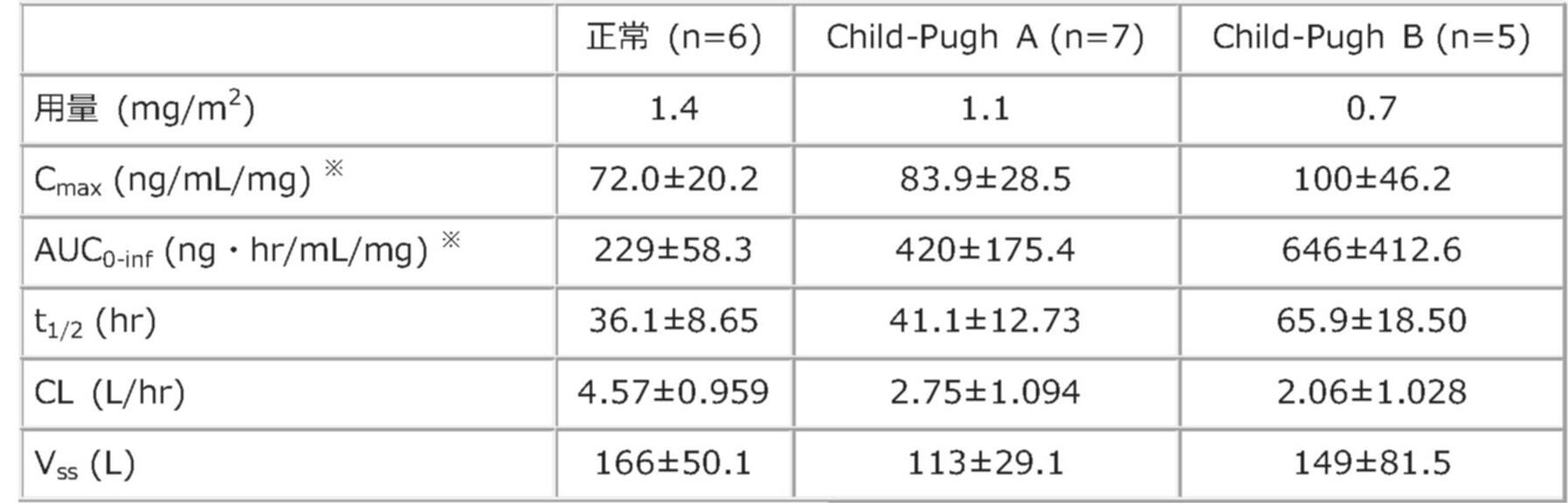
※エリブリンメシル酸塩製剤1mgあたりに補正した数
参考資料
*1) Devriese L. A., et al.:Cancer Chemother. Pharmacol. 2012;70(6):823-832
[作成 2024年12月]
-
過敏反応を予防するための前投薬は必要ですか?
過敏反応を予防するための副腎皮質ステロイドや抗ヒスタミン薬の使用は必須ではありません。
エリブリンメシル酸塩製剤の国内臨床試験では過敏反応の予防を目的とした前投薬は行われず、ショックなどの重篤な過敏反応の発現はありませんでした*1)。
参考資料
*1) ハラヴェン静注 国内第Ⅱ相試験(乳癌):221試験[進行又は再発乳癌を対象とした臨床第Ⅱ相試験(国内試験) (ハラヴェン静注:2011年4月22日承認、申請資料概要2.7.6.11)]
[作成 2024年12月]
-
用量制限毒性(DLT)は認められていますか?
本人固形がん患者を対象とした国内第I相試験において、エリブリンメシル酸塩製剤(0.7、1.0、1.4、2.0mg/m2)を1日目と8日目に静脈内投与し用量制限毒性(DLT)を検討しました。
その結果、1.4mg/m2群の6例中2例に、2.0mg/m2群の3例中3例に、好中球数減少や発熱性好中球減少症が認められました*1)。国内第I相試験の用量制限毒性の発現状況*1)

参考資料
*1) ハラヴェン静注 国内第Ⅰ相試験(固形がん):105試験[日本人固形がん患者を対象とした臨床第Ⅰ相試験 (国内試験)(ハラヴェン静注:2011年4月22日承認、申請資料概要2.7.6.3)]
[作成 2024年12月]
-
いつまで投与を継続したらよいですか?
エリブリンメシル酸塩製剤の臨床試験においては、病勢進行あるいは忍容できない毒性が発現するまで継続することと規定されていました。
なお、国内第II相試験*1)、外国第II、III試験*2)*3)*4)における投与状況は以下の通りです。
国内第II相試験、外国第II、III相試験でのエリブリンメシル酸塩製剤の投与状況*1)-*4)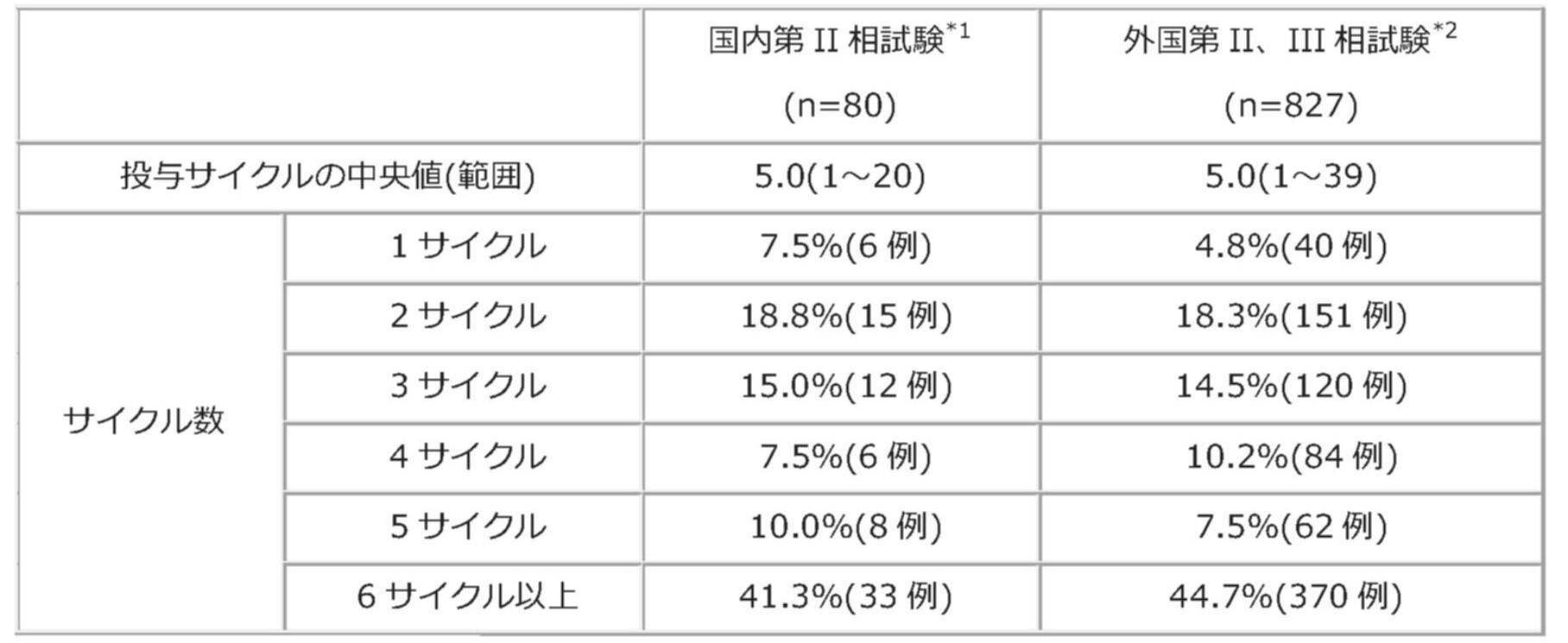
※1:国内第II相試験(221試験)
※2:外国201試験の3週サイクル群(n=33)、外国211試験(n=291)、外国305試験(n=503)の統合解析
参考資料
*1)ハラヴェン静注 国内第Ⅱ相試験(乳癌):221試験[進行又は再発乳癌を対象とした臨床第Ⅱ相試験(国内試験) (ハラヴェン静注:2011年4月22日承認、申請資料概要2.7.6.11)]
*2)ハラヴェン静注 外国第Ⅱ相試験(乳癌):201試験
*3)ハラヴェン静注 外国第Ⅱ相試験(乳癌):211試験
*4)ハラヴェン静注 外国第Ⅲ相試験(乳癌):305試験[進行又は再発乳癌を対象とした臨床第Ⅲ相試験(外国試験) (ハラヴェン静注:2011年4月22日承認、申請資料概要2.7.6.12)]
[作成 2024年12月]
-
放射線療法と併用できますか?
エリブリンメシル酸塩製剤と放射線療法を併用した場合の有効性及び安全性は確立していません。
ともに骨髄抑制作用を有するため、骨髄抑制作用が増強するおそれがあります。
[作成 2024年12月]
-
副作用としての注射部位反応の報告はありますか?
エリブリンメシル酸塩製剤の国内臨床試験では、注射部位そう痒感(Grade 1)、 注射部位反応(Grade 1)、 埋め込み部位炎症(Grade 1)、 静脈炎(Grade 2)が各1.2%(1/81例)に認められました*1)。
エリブリンメシル酸塩製剤の外国臨床試験では、静脈炎(Grade 1)が0.2%(1/503例)、注射・注入部位紅斑(Grade 1)、注射部位反応(Grade 1)が各0.4%(2/503例)に認められました*2)。
参考資料
*1)ハラヴェン静注 国内第Ⅱ相試験(乳癌):221試験[進行又は再発乳癌を対象とした臨床第Ⅱ相試験(国内試験) (ハラヴェン静注:2011年4月22日承認、申請資料概要2.7.6.11)]
*2) ハラヴェン静注 外国第Ⅲ相試験(乳癌):305試験[進行又は再発乳癌を対象とした臨床第Ⅲ相試験(外国試験) (ハラヴェン静注:2011年4月22日承認、申請資料概要2.7.6.12)]
[作成 2024年12月]
-
血管外漏出時の組織障害性は、何に分類されますか?
エリブリンは、「がん薬物療法に伴う血管外漏出に関する合同ガイドライン2023年版」において、非壊死起因性抗がん薬(非ベシカント薬:non-vesicants)※に分類されています。
なお、本剤に特有の対処法はないため、血管外漏出時には一般的な対処をお願いします。
※:薬剤が血管外に漏出したときに、組織が障害を受けたり破壊されたりすることはない(可能性は非常に低い)といわれる薬剤。
[作成 2024年12月]
製品名オメプラゾール注射用20mg「日医工」
-
投与間隔はどのくらいあければいいですか?
オメプラゾール注射用の投与間隔は規定されていません。
オメプラゾール注射剤投与後の胃内pHを検討した結果、単回投与後12時間後以降は効果が減弱するため、持続的な胃内pH上昇を得るためには12時間ごとの反復投与が必要、との報告があります。*1)
参考資料
*1)薬理と治療 23(suppl8)2107-2116,1995
[作成 2024年11月]
-
側管から投与する際にルート内を洗浄したほうがいいですか?
オメプラゾール注射用を側管から投与する場合、主管を止めて、オメプラゾール注射用の投与前後に生理食塩液または5%ブドウ糖液でルート内を洗浄していただくことをお奨めします。
オメプラゾール注射用は日局生理食塩液または日局5%ブドウ糖注射液以外の溶解液、輸液、補液及び他剤との混合注射は避けること、としています。*1)
また、配合変化試験では外観変化や含量低下を起こす組み合わせが多く報告されています。*2)
参考資料
*1)オメプラゾール注射用20mg「日医工」 添付文書
*2)オメプラゾール注射用20mg「日医工」 インタビューフォーム
[作成 2024年11月]
-
静注する際に溶解液量を減らすことはできますか?
オメプラゾール注射用を静注する場合、溶解液量を減らすことは安全性の面から推奨しておりません。
オメプラゾール注射用は高い濃度で投与したときに血管痛がおきた症例が報告されています。*1)
そのため、静注する場合はオメプラゾール20mgに対し20mLでの溶解をお願いします。*2)
参考資料
*1)薬理と治療 23(Suppl8)2081-2096,1995
*2)オメプラゾール注射用20mg「日医工」 添付文書
[作成 2024年11月]
製品名クロピドグレル錠「SANIK」
-
作用持続時間は?
クロピドグレルの血小板凝集抑制作用は不可逆的であるため、血小板の寿命中(8~10日)は、作用が持続します。*1)
参考資料
*1)クロピドグレル錠「SANIK」 インタビューフォーム
[作成 2024年11月]
-
飲み忘れた場合の対処法は?
クロピドグレル錠を飲み忘れた場合は、気がついた時にできるだけ早く1回分を服用します。次の服用予定時間が近い場合は1回分をとばし、次から時間通り服用いただくようお願いします。
飲み忘れに気づいても2回分を一度に服用しないように指導してください。*1)
ご参考までに、海外のクロピドグレル製剤の飲み忘れ時の対処法は、服用予定時間より12時間以上あいている場合は気づいた時点で服用する、12時間より短い場合は次回服用時に通常量を服用する、です。*2)
参考資料
*1)クロピドグレル錠25/75mg「SANIK」 くすりのしおり
*2)欧州クロピドグレル製剤 SmPC
[作成 2024年11月]
-
服用のタイミングは?
クロピドグレルは空腹時の投与を避けることをお奨めします。
クロピドグレルは国内第Ⅰ相試験で絶食投与時に消化器症状がみられています。そのため、空腹時の投与は避けることが望ましいとしています。*1)
なお、食事の影響を検討した試験では、空腹時投与と食後投与で、AUCと血小板凝集抑制率に差はなかったとの報告があります。*2)
参考資料
*1)クロピドグレル錠「SANIK」 添付文書
*2)クロピドグレル錠「SANIK」 インタビューフォーム
[作成 2024年11月]
製品名シスプラチン点滴静注「マルコ」
-
フィルター通過性は?
シスプラチン点滴静注「マルコ」は、フィルター通過性試験を行っておりません。
製造工程では、0.22μm以下のフィルターを用いてろ過を行っています。
[更新 2025年5月]
-
ショートハイドレーション(short hydration)とは?
ショートハイドレーションは、少量かつ短時間で行う補液法のことです。
シスプラチンの投与時に、10時間以上かけた大量補液(2.5L~5L)を行う場合入院が必要となることから、簡便かつ外来ベースでのシスプラチン投与の確立が望まれていました。*1)
国内外で補液法が研究され、現在国内各施設においても少量かつ短時間補液法が日常診療で行われるようになってきました。
なお、シスプラチン投与におけるショートハイドレーション法の手引きには、生理食塩液を含めた補液合計1.5~2.5Lを3時間~4時間30分かけて投与し、経口補液、マグネシウムと強制利尿薬を組み合わせた補液法の記載があります。*1)
ショートハイドレーションは最新の「がん薬物療法時の腎障害診療ガイドライン」等を参考にし、適用可能と考えられる患者様にのみ実施します。*2)
参考資料
*1) シスプラチン投与におけるショートハイドレーション法の手引き(2024.11.21),日本肺癌学会
*2) シスプラチン点滴静注「マルコ」添付文書
[改訂 2025年5月]
-
添付文書に「点滴時間が長時間に及ぶ場合には遮光して投与すること」と記載がありますが、どのくらいの時間から遮光が必要ですか?
遮光が必要な時間について具体的な規定はありません。
シスプラチン点滴静注10mg「マルコ」と大塚生食注500mLとの配合において、室温・室内散光下、24時間で外観は無色澄明、pH6.20(開始時pH 6.32)、残存率は93.6%でした。*1)
参考資料
*1) シスプラチン点滴静注「マルコ」 インタビューフォーム
[更新 2025年5月]
-
聴力低下・難聴、耳鳴が生じることはありますか? 対処法は?
シスプラチンの重大な副作用に聴力低下・難聴、耳鳴があります。
投与量の増加に伴い聴器障害の発現頻度が高くなり、特に1日投与量では80mg/m2以上、総投与量では300mg/m2を超えるとその傾向は顕著になります。*1)
聴器障害は投与開始直後から生じ投与反復により進行し、通常は両側性である、とされています。*2)
対処法は確立されていません。
投与中は十分な観察を行うようお願いします。
【参考資料】
*1)シスプラチン点滴静注「マルコ」添付文書
*2)重篤副作用疾患別対応マニュアル 難聴 厚生労働省
[更新 2025年5月]
-
末梢神経障害が生じることはありますか? 対処法は?
シスプラチンのその他の副作用に末梢神経障害があります。
シスプラチンの累積投与量が増えると末梢神経障害の発現割合が高くなります。累積投与量が250~500mg/m2で神経毒性が出現し、900mg/m2で50%、1,300mg/m2で100%に起こると報告されています。*1)
がん薬物療法に伴う末梢神経障害診療ガイドラインでは、感覚障害は四肢末梢、体幹、顔面に発生しますが、運動障害は少ないとの記載があります。
また、末梢神経障害には根本的な治療法がないため、被疑薬の投与の延期、減量あるいは中止が現実的なマネジメント法の1つであるとの記載があります。*2)
参考資料
*1) 重篤副作用疾患別対応マニュアル 末梢神経障害 厚生労働省
*2) がん薬物療法に伴う末梢神経障害診療ガイドライン 2023年版 p38-39
[作成 2025年5月]
製品名ステロネマ注腸
-
投与するタイミングは?
ステロネマ注腸を投与する時間のタイミングは規定されていません。
一般的に、入浴後や就寝前が投与に適した時間とされています。*1)
参考資料
*1)患者様向け指導箋 ステロネマ注腸を使用される方へ
[更新 2024年5月]
-
挿入しやすくする方法は?
挿入するチューブの先端にオリーブ油やワセリン、グリセリン等または水を塗ると挿入しやすくなります。*1)
また、挿入時の姿勢や挿入の長さが適切かどうかも合わせてご確認ください。
参考資料
*1)ステロネマ注腸 添付文書
[更新 2024年5月]
-
体位変換の目的は?
体位変換は薬液を大腸深部まで到達させるために行います。*1)
体位変換は、主治医から指示があった場合に行ってください。体位変換の具体的な手順は患者様向け指導箋に記載しています。
参考資料
*1)Therapeutic Research12(8)2605-2615,1991
[更新 2024年5月]
-
注腸後の排便感を回避するための方法は?
以下の方法が挙げられます。*1)
- ・注腸前にステロネマ注腸を体温程度の温度に温める
- ・注腸前に排便を済ませておく
- ・注腸速度を遅くする
- ・無理に全量を注腸しない
- ・体位変換はゆっくり行う
- ・体位変換後はなるべく安静にする
参考資料
*1)患者様向け指導箋 ステロネマ注腸を使用される方へ
[更新 2024年5月]
製品名デカドロン
-
錠剤のバイオアベイラビリティは?
健康成人におけるデキサメタゾンのバイオアベイラビリティを検討した結果、注射剤を100%とした場合、錠剤は78.0%であった、との報告があります。*1)*2)
参考資料
*1)Clin Pharmacol Ther 18(2)205-209,1975
*2)デカドロン錠0.5mg/4mg インタビューフォーム
[更新 2025年4月]
-
多発性骨髄腫に使用してもいいですか?
デカドロン錠は多発性骨髄腫に対する効能効果を取得していませんので、使用はお奨めしておりません。*1)
参考資料
*1)デカドロン錠 添付文書
[更新 2024年5月]
製品名ドグマチール
-
中止の方法は?
ドグマチールの中止方法は確立されていません。
モーズレイ処方ガイドライン第14版では、抗精神病薬を急に中止した場合、頭痛や悪心、不眠症などの中断症状があらわれることがあるため、長期間投与後は綿密にモニタリングしながら段階的に中止すべき、との記載があります。*1)
参考資料
*1)モーズレイ処方ガイドライン第14版 日本語版p27,2022,ワイリー・パブリッシング・ジャパン株式会社
[更新 2024年5月]
-
過量投与時の症状と対処法は?
スルピリドの過量投与時には、パーキンソン症候群等の錐体外路症状のほか、昏睡があらわれることがあります。*1)
また、急性中毒情報ファイルではスルピリドの中毒症状として、口渇、胸やけ、悪心、嘔吐等も記載されています。*2)
対処法として特異的なものはありません。
急性中毒情報ファイルのスルピリドの項では一般的な処置として胃洗浄のほか活性炭や下剤の投与、輸液があげられています。*2)
参考資料
*1)ドグマチール錠/カプセル/細粒/筋注 添付文書
*2)急性中毒情報ファイル第4版p426,2008,廣川書店
[更新 2024年5月]
製品名トリプタノール
-
夜尿症に対する作用機序は?
トリプタノール錠の夜尿症に対する作用機序は明らかになっていません。
三環系抗うつ薬の夜尿症に対する機序として、抗うつ効果のほか、抗コリン作用、睡眠と覚醒の調節、ノルアドレナリン系の神経伝達物質の取り込み阻害、抗利尿ホルモン分泌刺激作用があると推察されています。*1)
参考資料
*1)夜尿症診療ガイドライン2021p35,診断と治療社
[更新 2024年5月]
-
神経障害性疼痛に対する作用機序は?
トリプタノール錠の神経障害性疼痛に対する作用機序は、主にセロトニン・ノルアドレナリン再取り込み阻害作用を介した下行性疼痛抑制系の活性化であり、その他にNMDA受容体拮抗作用やNa+チャネル遮断作用も関与している、と考えられています。*1)
参考資料
*1)神経障害性疼痛薬物療法ガイドライン改訂第2版p59,2016,真興交易(株)
[更新 2024年5月]
-
夜尿症に使用する場合の対象年齢は?
トリプタノール錠を夜尿症に用いる場合の対象年齢は規定されていません。*1)
夜尿症診療ガイドライン2021では、
夜尿症の定義の一つとして「5歳以上の小児の就眠中の間欠的尿失禁」との記載があります。*2)
参考資料
*1)トリプタノール錠10/25 添付文書
*2)夜尿症診療ガイドライン2021p3,診断と治療社
[更新 2024年5月]
-
夜尿症に使用する場合の用法用量は?
トリプタノール錠の夜尿症の用法用量は、「1日10~30mgを就寝前に経口投与する、なお年齢、症状により適宜減量する」です。*1)
夜尿症診療ガイドライン2021では、
夕食後または就寝前に10mgから投与を開始し、1週間後に効果がみられない場合、体重25kg未満では20mg、25kg以上では25~30mgへ増量する、
との記載があります。*2)
参考資料
*1)トリプタノール錠10/25 添付文書
*2)夜尿症診療ガイドライン2021p35,診断と治療社
[更新 2024年5月]
-
過量投与時の症状と対処法は?
トリプタノール錠の過量投与時には、嗜眠、低血圧、不整脈、呼吸抑制等があらわれることがあります。*1)
(詳細は添付文書をご確認ください)
過量投与時の対処法として特異的なものはありません。一般的な対処をお願いいたします。
新版 急性中毒標準診療ガイドでは、三環系抗うつ剤中毒の治療法として、全身管理や合併症対策、腸管内や体内の薬物の除去があげられており、心電図モニターが勧められています。*2)
また、急性中毒情報ファイルの三環系抗うつ剤の項では、呼吸管理、胃洗浄のほか活性炭や下剤、輸液の投与、心電図計による連続監視などがあげられています。*3)
心電図検査で異常が見られた場合には、少なくとも5日間は心機能を観察してください。*1)
参考資料
*1)トリプタノール錠10/25 添付文書
*2)新版 急性中毒標準診療ガイドp195, 2023,へるす出版
*3)急性中毒情報ファイル第4版p424,2008,廣川書店
[改訂 2024年5月]
製品名注射用フィルデシン
-
フィルター通過性は?
注射用フィルデシンは、フィルター通過性試験を行っておりません。
なお、注射用フィルデシンを生理食塩液で溶解し0.22μmのポリエーテルスルホン膜輸液フィルターを通過させた際、約99%以上の薬剤が通過することから、輸液フィルターへの吸着は臨床効果に多大な影響は及ぼさないと考えられる、との報告があります。*1)
参考資料
*1)静脈経腸栄養16(4)71-78,2001
[更新 2025年5月]
-
調製後、数時間以内に使用する理由は?
注射用フィルデシンには、保存剤が添加されていないためです。*1)
ご参考に、添付文書の調製法に従った注射用水または生理食塩液による溶解後の安定性試験では、24時間まで、外観、pH、分解物、含量に変化は見られていません。*2)
*1) 注射用フィルデシン 添付文書
*2) 注射用フィルデシン インタビューフォーム
[更新 2025年5月]
製品名フェジン静注40mg
-
生理食塩液で希釈してもいいですか?
フェジンを生理食塩液で希釈することは避けていただくようお願いします。
フェジンはpH9.0~10.0で安定なコロイド製剤です。*1)
生理食塩液で希釈した場合、pHの変動や電解質の影響によりフェジンのコロイド状態が不安定となり、遊離した鉄イオンが多量に生じるおそれがあります。遊離した鉄イオンは生体組織に直接作用し、発熱、悪心、嘔吐などの原因となる可能性があります。
フェジンを希釈する場合は、用時10~20%のブドウ糖注射液で5~10倍に希釈してください。*2)
参考資料
*1)フェジン静注40mg インタビューフォーム
*2)フェジン静注40mgを安全にご使用いただくために 2011年10月
[更新 2024年5月]
-
側管から投与する際にルート内を洗浄したほうがいいですか?
フェジンを側管から投与する場合、主管を止めて、フェジンの投与前後に10~20%のブドウ糖液でルート内を洗浄していただくことをお奨めします。
フェジンはpH9.0~10.0で安定なコロイド製剤です。*1)
他剤との配合によってフェジンのコロイド状態が不安定になると、遊離した鉄イオンが多量に生じるおそれがあります。遊離した鉄イオンは、生体組織に直接作用し、発熱、悪心、嘔吐などの原因となる場合があります。*2)
参考資料
*1)フェジン静注40mg インタビューフォーム
*2)フェジン静注40mgを安全にご使用いただくために 2011年10月
[改訂 2024年5月]
-
投与期間の制限は?
フェジンの投与期間に制限はありません。
ただし、フェジンを過量に投与した場合、鉄過剰症が生じるおそれがあります。鉄過剰症を防ぐために、フェジンでの治療は、開始前にあらかじめ投与回数・日数を決めていただくことが大切です。
まず患者様のヘモグロビン値、体重から総投与鉄量を求めます。次に求めた総投与鉄量を、1回の投与量(鉄としてのmg数)で割り、投与回数を算出します。フェジンを1日1回で投与する場合、投与回数=投与日数です。
総投与鉄量の算出は添付文書をご参照ください。*1)
なお、投与後の検査値によっては、必ずしも求めた総投与鉄量を全量投与する必要はありません。
[用法・用量に関連する使用上の注意]*1)
本剤の投与に際しては、あらかじめ必要鉄量を算出し、投与中も定期的に血液検査を行い、フェリチン値等を確認するなど、過量投与にならないよう注意すること。
参考資料
*1)フェジン静注40mg 添付文書
[更新 2024年5月]
-
経口鉄剤との使い分けは?
通常、フェジンは経口鉄剤の投与が困難または不適当な場合に限り使用されます。*1)
鉄剤の適正使用による貧血治療指針では、副作用が強く経口鉄剤が飲めない、出血など鉄の損失が多く経口鉄剤で間に合わない、消化器疾患で内服が不適切、鉄吸収が極めて悪い、といった状況では静注鉄剤が適用となる、と記載があります。*2)
参考資料
*1)フェジン静注40mg 添付文書
*2)鉄剤の適正使用による貧血治療指針 改訂[第3版]p44-49,2015,響文社
[更新 2024年5月]
製品名注射用フサン
-
5%ブドウ糖液、注射用水以外で溶解してもいいですか?
フサンを5%ブドウ糖液、注射用水以外で溶解することはお奨めしておりません。
生理食塩液または無機塩類を含有する溶液、電解質を多く含む輸液をバイアルに直接加えた場合、不溶性の塩が形成され白濁することや、結晶が析出することがあります。
そのため、5%ブドウ糖液または注射用水を用いて確実に溶解してからご使用をお願いします。*1)
参考資料
*1)注射用フサン10/50 添付文書
[更新 2024年5月]
-
膵炎、DICの投与時間設定の理由は?
フサンの投与時間は、治療の対象となる病態に合わせて設定されています。
膵炎の場合、フサンは急性増悪期の症状を改善するために使用されます。
またDICの場合は、基礎疾患が原因となって生じる全身性の血液凝固系の異常症状であるため、フサンを長時間投与する必要があります。
これらの理由からフサンの投与時間は、膵炎では2時間、DICでは24時間に設定されました。
[更新 2024年5月]
-
血管外漏出時の対処法は?
フサンが血管外漏出した場合の特有な対処方法はありません。抗がん剤漏出時の処置などを参考に、対症療法の検討をお願いします。
がん薬物療法に伴う血管外漏出に関する合同ガイドラインでは、抗がん剤漏出時の処置例として、
・皮膚障害・炎症の悪化・進行を防ぐために局所療法として冷罨法(冷却)を行う
・ステロイド外用剤塗布を行う
・保存療法を施行しても皮膚障害が悪化し、難治性の潰瘍や壊死が生じた場合は外科的処置(デブリードメント)を行う
などが記載されています。*1)
参考資料
*1) がん薬物療法に伴う血管外漏出に関する合同ガイドライン2023年版p4-5、81-112,日本がん看護学会/日本臨床腫瘍学会/日本臨床腫瘍薬学会編,金原出版株式会社
[更新 2024年5月]
製品名プリンペラン
-
効果発現時間は?
プリンペランは効果発現時間の評価を目的とした臨床試験は実施していません。
ご参考までに、書籍において経口では服用後30~60分、筋肉内注射は10~15分、静脈内注射は1~3分で作用が発現する、との記載があります。*1)
参考資料
*1)グッドマン・ギルマン薬理書(下巻) 第13版,p1514-1515,2022年,廣川書店
[更新 2024年5月]
-
食後に投与してもいいですか?
プリンペランの食後投与はお奨めしておりません。
プリンペランは、胃運動の低下した状態に対して胃・十二指腸運動を亢進し、胃内容物の排出を促進する作用があります。*1)*2)*3)
食後の胃内容物が長く胃内にとどまらないようにするため、プリンペランは食前に投与をお願いします。
参考資料
*1)新薬物治療研究会2回総会講演内容集55-59,1965
*2)新薬物治療研究会2回総会講演内容集65-73,1965
*3)診療と新薬 3(12)2065-2068,1966
[更新 2024年5月]
-
投与間隔はどのくらいあければいいですか?
プリンペランの投与間隔は規定されていません。
ご参考までに、海外のメトクロプラミド製剤は過量投与を避けるため、注射剤、経口剤ともに投与間隔は少なくとも6時間あけるべきである、とされています。*1)
参考資料
*1)英国メトクロプラミド製剤 SmPC
[更新 2024年5月]
製品名ヨウ化カリウム
-
服用のタイミングは?
ヨウ化カリウムは、食後30分で服用することをお奨めします 。
食直後に服用した場合、ヨウ化カリウムは胃内容物に吸着するおそれがあります。*1)
また、空腹時に服用した場合は、ヨウ化カリウムの刺激性により胃障害が起きるおそれがあります。*2)
参考資料
*1)ヨウ化カリウム丸50mg「日医工」 添付文書
*2)第八改正日本薬局方第二部解説書
[更新 2025年4月]
-
製剤中のヨウ素量とカリウム量は?
ヨウ化カリウム丸50mg「日医工」は、1丸中にヨウ素約38.2mg、カリウム約11.8mgを含みます。
[更新 2025年4月]
-
医療用と自治体用の製剤の違いは?
ヨウ化カリウム丸50mg「日医工」、の医療用と自治体用に製剤の違いはありません。ただし、個装箱のデザインは異なっています。
自治体用は、有事に国などの指示のもと配布するための自治体の備蓄用の製品です。備蓄しておくため使用期限をより長く確保する必要があり受注生産を行っています。そのため医療用とは区別しています。
[更新 2025年4月]