医療関係業者向けサイト
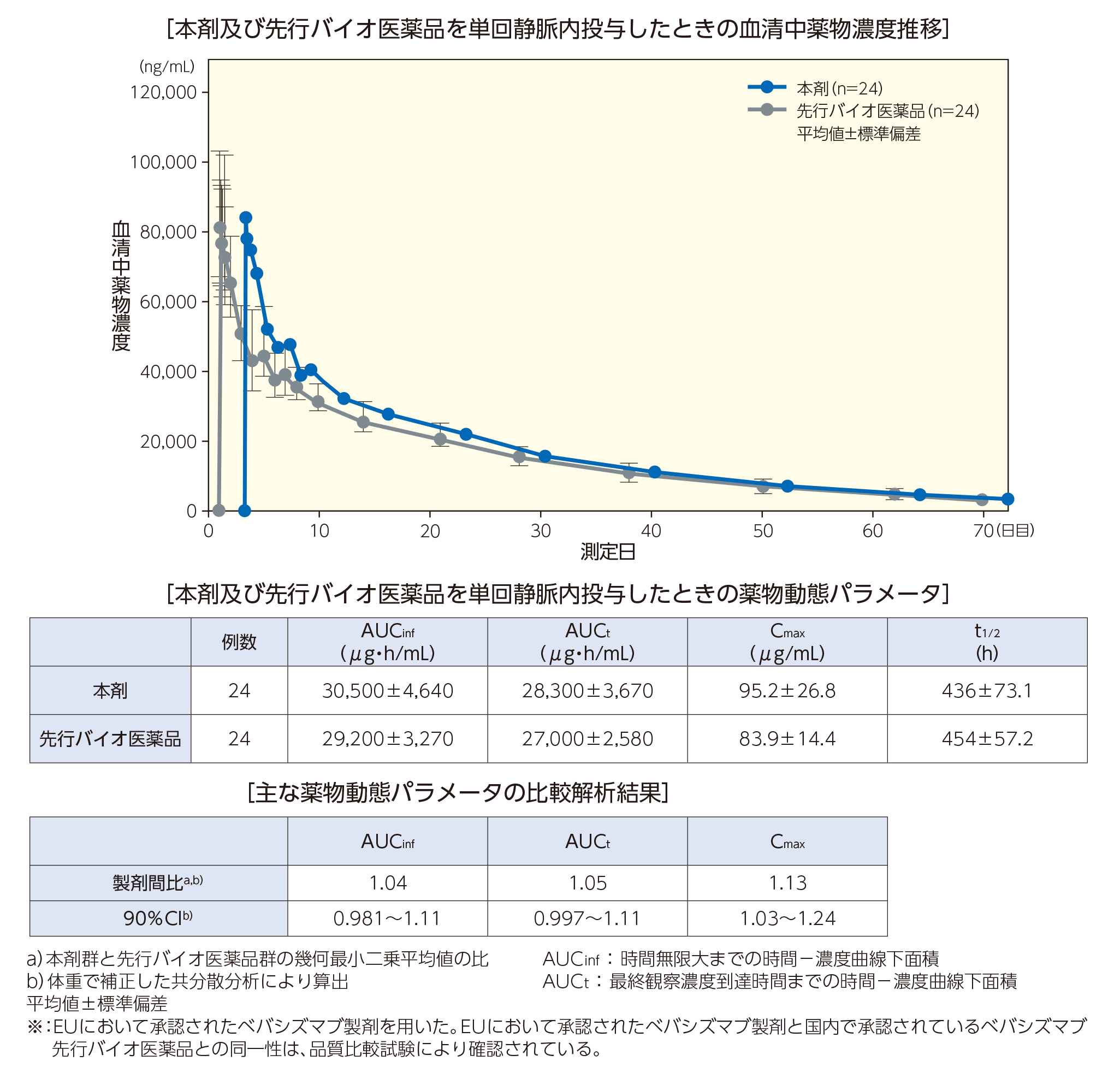
薬物動態単回投与(国内第Ⅰ相臨床試験)
単回投与(国内第Ⅰ相臨床試験)
日本人健康男性被験者を対象に,本剤(n=24)又は先行バイオ医薬品※(n=24)を3mg/kgで単回点滴静脈内投与し,血清中濃度を測定した。得られた薬物動態パラメータ(AUCinf)の幾何平均値の比の90%信頼区間は、事前に設定した基準内(0.80~1.25)であり、薬物動態において本剤と先行バイオ医薬品の同等性が確認された。
- 日医工株式会社 社内資料:国内第Ⅰ相臨床試験(承認時評価資料)
ベバシズマブBS点滴静注100mg/400mg「日医工」の用法及び用量
〈治癒切除不能な進行・再発の結腸・直腸癌〉
他の抗悪性腫瘍剤との併用において,通常,成人にはベバシズマブ(遺伝子組換え)[ベバシズマブ後続3]として1回5mg/kg(体重)又は10mg/kg(体重)を点滴静脈内注射する。投与間隔は2週間以上とする。他の抗悪性腫瘍剤との併用において,通常,成人にはベバシズマブ(遺伝子組換え)[ベバシズマブ後続3]として1回7.5mg/kg(体重)を点滴静脈内注射する。投与間隔は3週間以上とする。
〈扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌〉
他の抗悪性腫瘍剤との併用において,通常,成人にはベバシズマブ(遺伝子組換え)[ベバシズマブ後続3]として1回15mg/kg(体重)を点滴静脈内注射する。投与間隔は3週間以上とする。
〈手術不能又は再発乳癌〉
パクリタキセルとの併用において,通常,成人にはベバシズマブ(遺伝子組換え)[ベバシズマブ後続3]として1回10mg/kg(体重)を点滴静脈内注射する。投与間隔は2週間以上とする。