医療関係業者向けサイト
臨床試験海外第Ⅲ相比較試験 安全性
海外第Ⅲ相比較試験 安全性
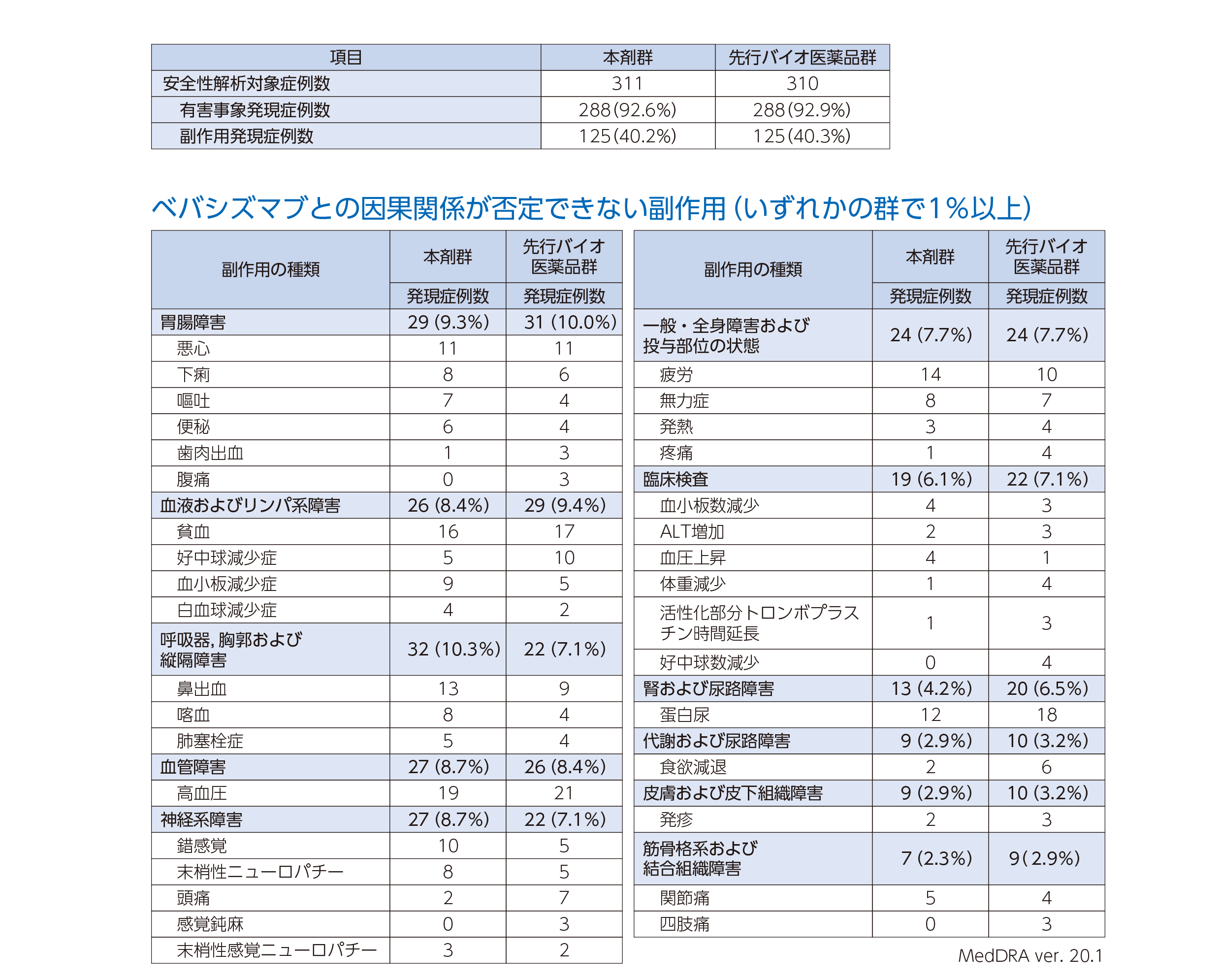
52週までにおいて,有害事象は本剤群の288例(92.6%)及び先行バイオ医薬品群の288例(92.9%)に認められ,このうちベバシズマブ(本剤及び先行バイオ医薬品)との因果関係が否定できない副作用は本剤群の125例(40.2%)及び先行バイオ医薬品群の125例(40.3%)に認められた。
重篤な副作用は本剤群21例(6.8%)及び先行バイオ医薬品群18例(5.8%)であった。最もよく見られた重篤な副作用は,肺塞栓症[本剤群4例(1.3%)及び先行バイオ医薬品群4例(1.3%)]であった。
治験薬の投与中止に至った副作用は本剤群25例(8.0%)及び先行バイオ医薬品群18例(5.8%)であった。最もよく見られた治験薬の投与中止に至った副作用は,肺塞栓症[本剤群5例(1.6%),先行バイオ医薬群3例(1.0%)],蛋白尿[先行バイオ医薬品群4例(1.3%)]であった。
死亡に至った副作用は本剤群6例(1.9%)及び先行バイオ医薬品群3例(1.0%)3件であった。その副作用の内訳は,本剤群,肺出血,ネフローゼ症候群,喀血,胃潰瘍,急性心筋梗塞,心肺停止各1例,先行バイオ医薬品群,肺出血,急性腎障害,肺塞栓症各1例であった。

- 日医工株式会社 社内資料:海外第Ⅲ相比較試験(承認時評価資料)