医療関係業者向けサイト
臨床試験海外第Ⅲ相比較試験 有効性
海外第Ⅲ相比較試験 有効性
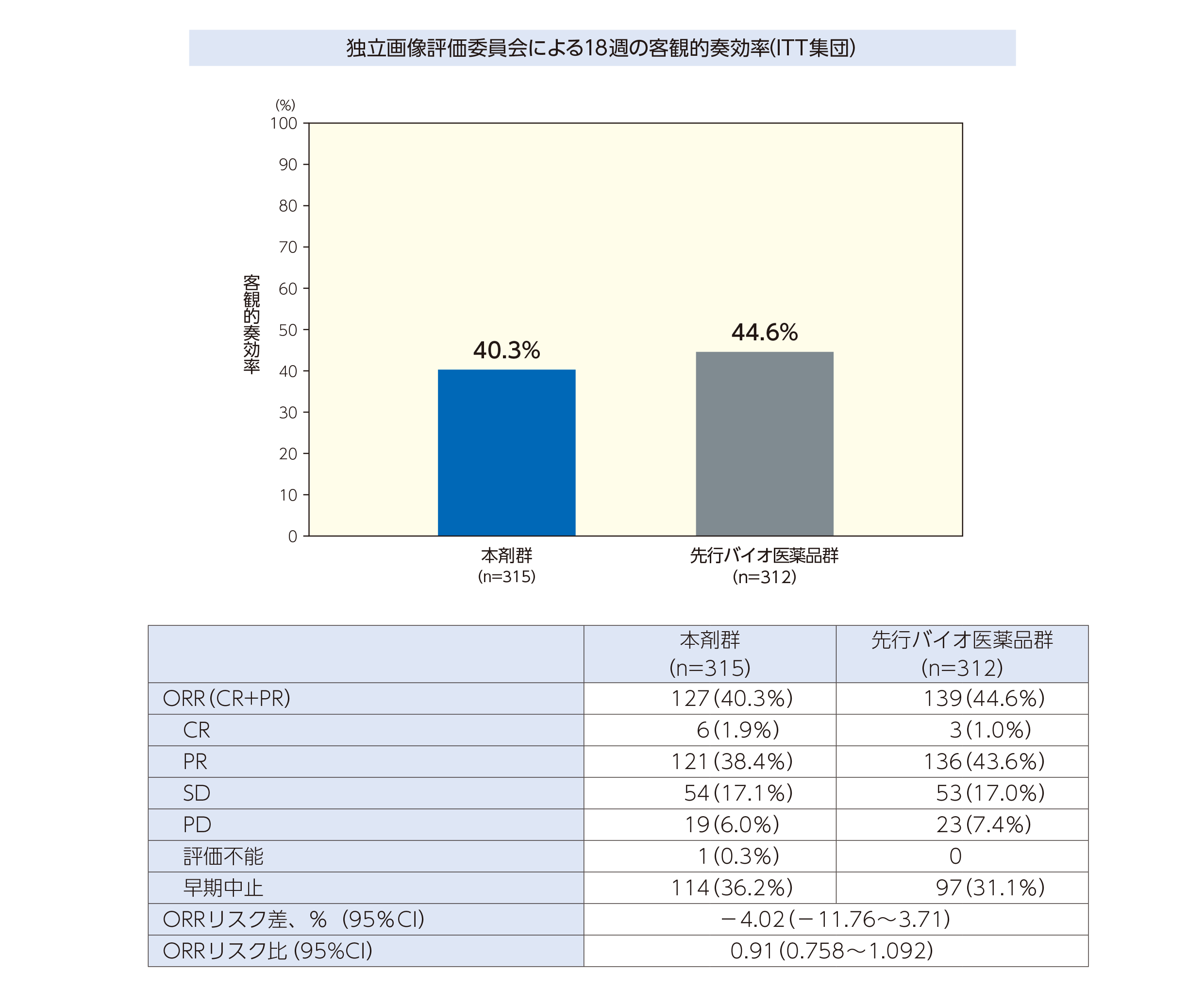
1.18週の客観的奏効率(ORR)<主要評価項目>
独立画像評価委員会による18週のORRは本剤群40.3%,先行バイオ医薬品用群44.6%であった。性別,喫煙状況,疾患診断,及び病期を共変量とした層別因子を用いて調整したORRのリスク差は−4.02%(95%CI:−11.76%~3.71%),ORRのリスク比は0.910(95%CI:0.758~1.092)であり,事前に設定したリスク差の同等性の基準(−12%~12%)及びリスク比の同等性の基準(0.73~1.36)を満たしていることから,本剤は先行バイオ医薬品用と同等の有効性を有することが検証された。
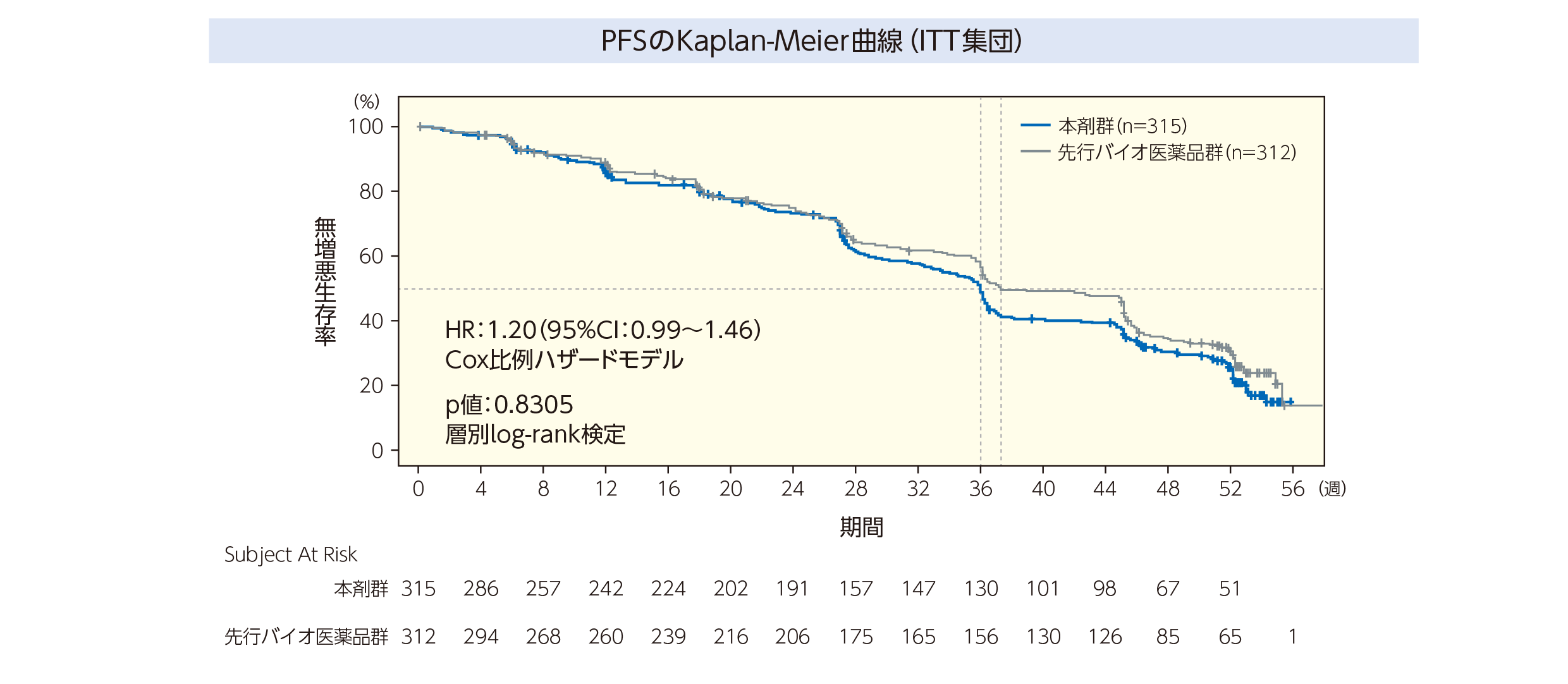
2.無増悪生存期間(PFS)<副次評価項目>
治験担当医師による評価では,PFS中央値は本剤群36.0週(95%CI:33.0~36.4)及び先行バイオ医薬品用群37.3週(95%CI:36.1~45.1)であった。調整したハザード比は,1.20(95%CI:0.99~1.46,p=0.8305,Cox比例ハザードモデル)であった。PFSの結果についても,本剤と先行バイオ医薬品用の有効性の同等性を支持するものであった。
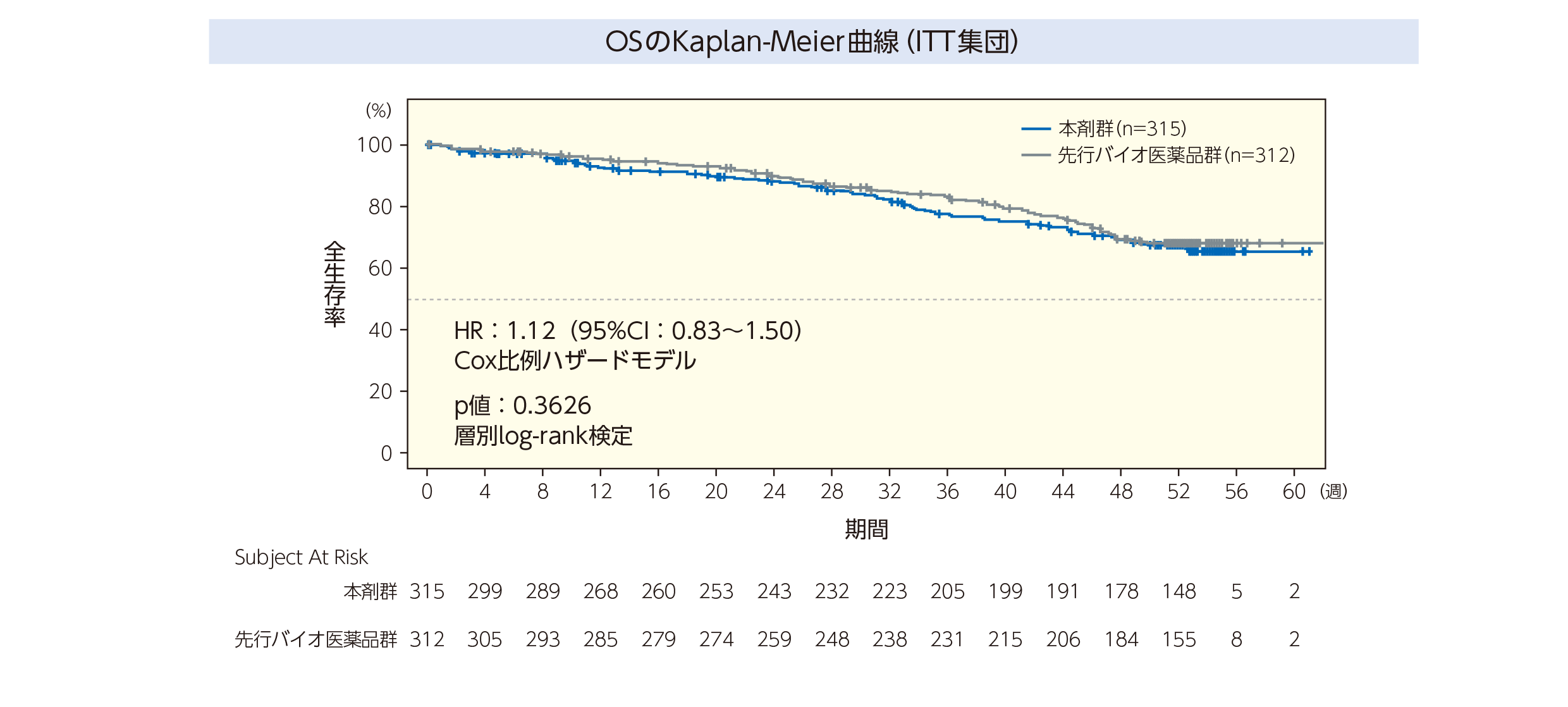
3.全生存期間(OS)<副次評価項目>
Kaplan-Meier法で推定した各群のAUCから算出した最小二乗境界内平均生存期間(RMST)は,本剤群46.5週(95%CI:45.8~47.2)及び先行バイオ医薬品用群48.5週(95%CI:47.9~49.1)であった。調整したハザード比は,1.12(95%CI:0.83~1.50,p=0.3626,Cox比例ハザードモデル)であった。OSの結果についても,本剤と先行バイオ医薬品用の有効性の同等性を支持するものであった。
- 日医工株式会社 社内資料:海外第Ⅲ相比較試験(承認時評価資料)