医療関係業者向けサイト
臨床試験国内第Ⅲ相試験安全性
国内第Ⅲ相試験安全性
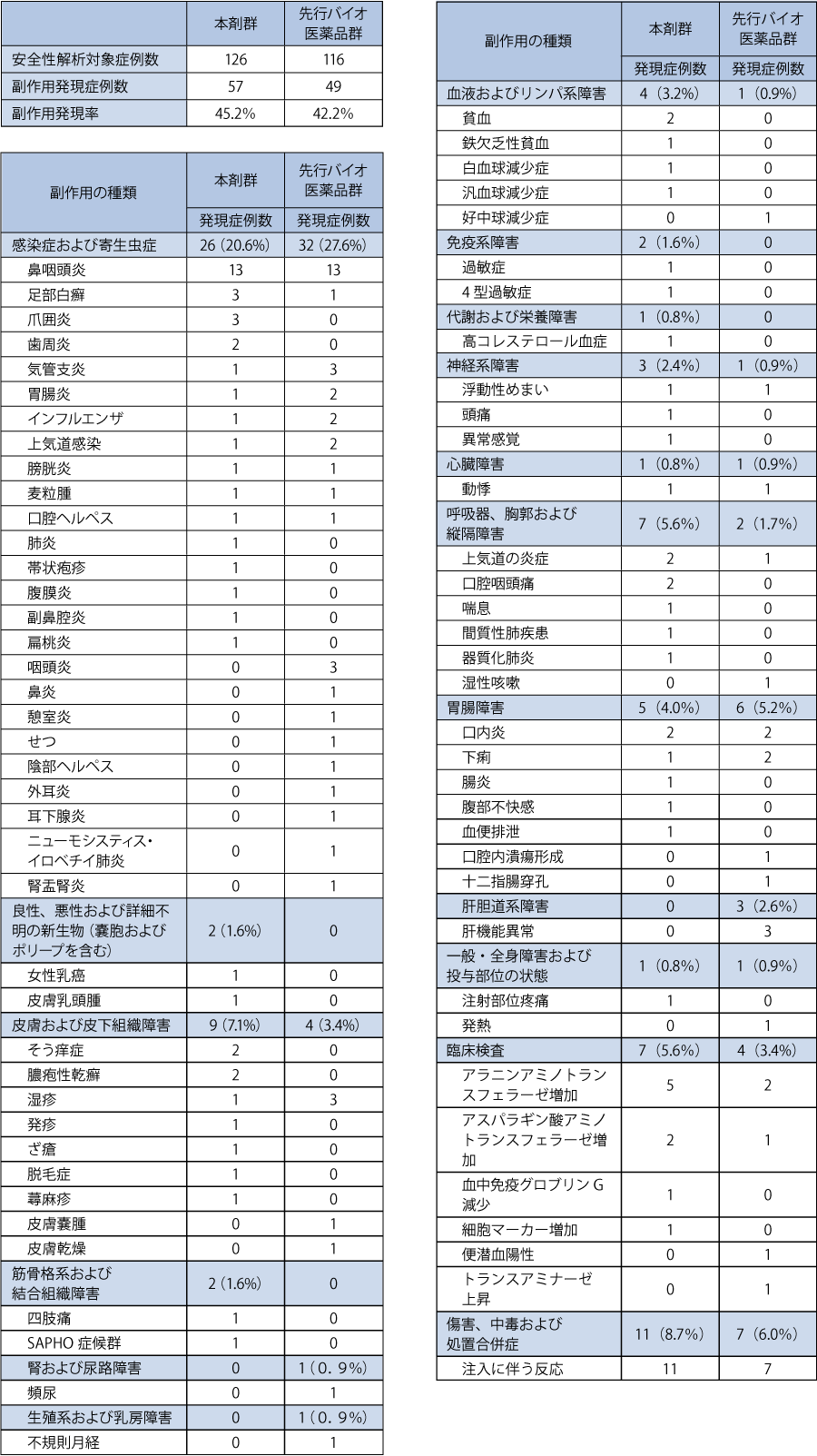
1. 第Ⅰ期の安全性
有害事象は本剤群の92例(73.0%)及び先行バイオ医薬品群の89例(76.7%)に認められ,副作用は本剤群の57例(45.2%)及び先行バイオ医薬品群の49例(42.2%)に認められた。重篤な副作用は,本剤群では汎血球減少症,女性乳癌,腸炎,腹膜炎,間質性肺疾患,肺炎が各1例に認められ,先行バイオ医薬品群では肺炎,腎盂腎炎,十二指腸穿孔,ニューモシスティス・イロベチイ肺炎が各1例に認められた。副作用による投与中止は,本剤群では注入に伴う反応が3例,アラニンアミノトランスフェラーゼ増加,汎血球減少症,間質性肺疾患,肺炎,血中免疫グロブリンG減少,女性乳癌,器質化肺炎,腹膜炎が各1例に認められた。先行バイオ医薬品群では,注入に伴う反応が2例,腎盂腎炎,十二指腸穿孔,ニューモシスティス・イロベチイ肺炎,発熱,耳下腺炎,アラニンアミノトランスフェラーゼ増加,肺炎が各1例に認められた。
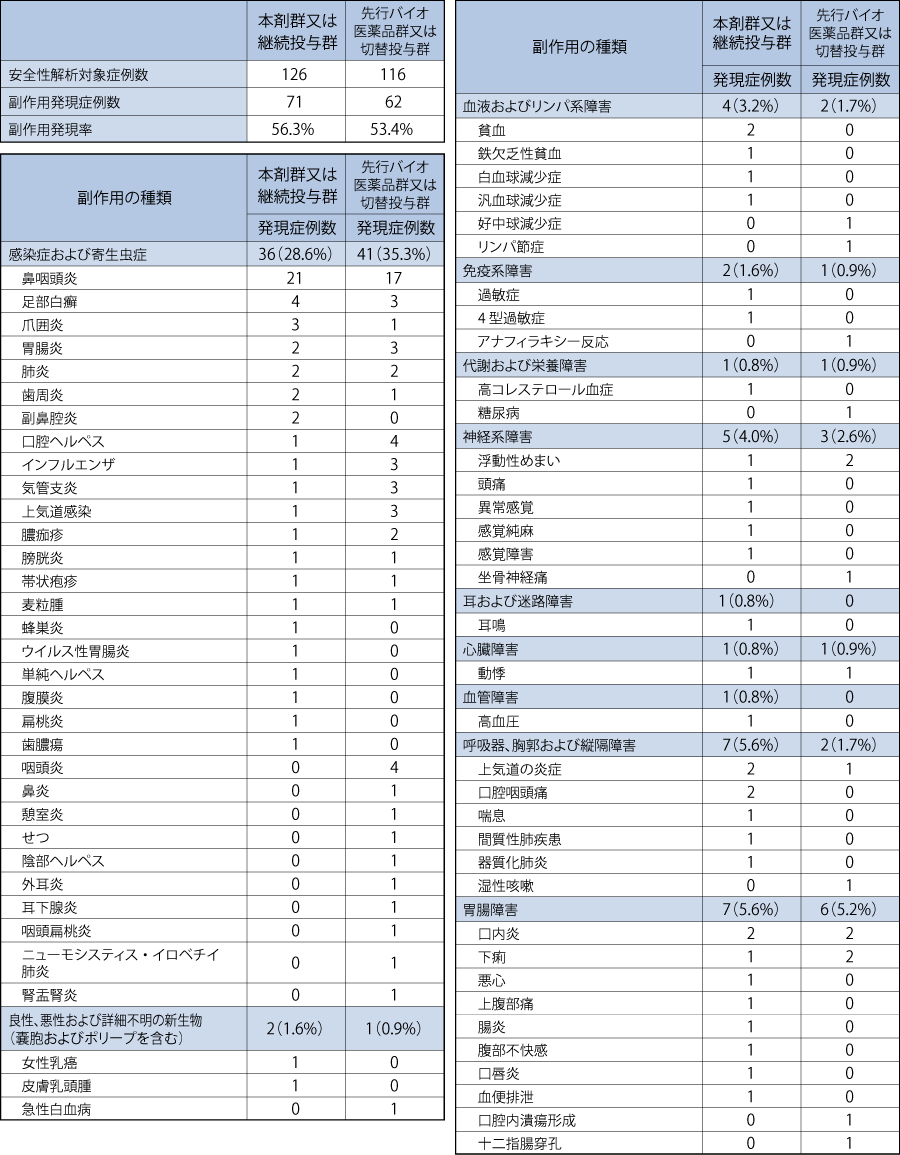
2. 長期投与の安全性
本剤投与開始から54週時点の有害事象は,本剤群又は継続投与群の108例(85.7%),先行バイオ医薬品群又は切替投与群の99例(85.3%)に認められ,副作用は本剤群又は継続投与群の71例(56.3%),先行バイオ医薬品群又は切替投与群の62例(53.4%)に認められた。