診療現場最前線 はじめに 制吐療法:大腸癌薬物療法を例に
掲載日:2022年7月25日
監修の先生の肩書更新:2023年4月20日

橋本 浩伸 先生
国立がん研究センター中央病院
薬剤部 部長
がん薬物療法を行う医療者は、最適な治療方針のもとに適切な薬物療法を選択し、治療効果を最大化するだけでなく、患者さんの苦痛と副作用のリスクを最小化することも考えなければなりません。
がん薬物療法によって発現する悪心・嘔吐(chemotherapy-induced nausea and vomiting:CINV)は、かつては患者さんが治療を受けるうえで最も辛いと訴える副作用でした1)。嘔吐・悪心は、催吐の機序が解明され、そこに作用する薬剤が開発された現状においても、患者さんが苦痛と感じる代表的な副作用です。そのため、これを適切に制御することは、患者さんが治療を続けていくうえで重要な意味を持ちます。
「診療現場最前線 はじめに 制吐療法:大腸癌薬物療法を例に」では、日本癌治療学会の「制吐薬適正使用ガイドライン」〔2015年10月【第2版】一部改訂版 ver.2.2(2018年10月)〕に基づいた「制吐療法」の基礎知識を中心に解説します。
Vol.1~Vol.3では、大腸癌の薬物療法における制吐療法を例に、制吐療法の実際や地域の病院と薬局における連携のポイント、薬剤師に対する期待などについて、処方医、病院薬剤師、保険薬局薬剤師の立場からお話いただきます。
- de Boer-Dennert M, et al.: Br J Cancer. 1997; 76(8): 1055-1061.
目次
各製剤の詳細は電子添文をご参照ください。
悪心・嘔吐とは
悪心とは、嘔吐しそうな不快感を指し、嘔吐とは、胃の内容物を強制的に排出させる運動を指します。
悪心・嘔吐は、上部消化管に優位に存在する5-HT3受容体と第4脳室のchemoreceptor trigger zone(CTZ)に存在するNK1受容体、ドパミンD2受容体が複合的に刺激され、延髄の嘔吐中枢が興奮することで悪心を感じ、さらに臓器の反応が起こることで嘔吐すると考えられています。
化学受容体で作用する神経伝達物質としては、セロトニン、サブスタンスP、ドパミンなどが知られており、これらと拮抗する薬剤などが制吐薬として用いられています。がん薬物療法によって発現する悪心・嘔吐は、発現の状態により以下のように分類されます(表1)。
表1 悪心・嘔吐の分類

日本癌治療学会: 「制吐薬適正使用ガイドライン」2015年10月【第2版】一部改訂版 ver.2.2(2018年10月)より作成
http://www.jsco-cpg.jp/item/29/index.html(2022年5月閲覧)
悪心・嘔吐に対するリスクの把握
悪心・嘔吐に対するリスクを催吐性リスクとよびます。がん薬物療法の催吐性リスクは、制吐薬の予防的投与なしで抗がん薬投与後24時間以内に発現する悪心・嘔吐(急性の悪心・嘔吐)の割合(%)に従って定義され、4つに分類されています(表2)。
実際の薬物療法では、単剤ではなく複数の薬剤が使用される場合が多く、その際はレジメンに含まれる薬剤の中で最も高い催吐性リスクを有する薬剤に準じたリスクに分類されます。
例として、大腸癌薬物療法に用いる主なレジメンの催吐性リスクを示します(表3)。
表2 催吐性リスク分類

日本癌治療学会: 「制吐薬適正使用ガイドライン」2015年10月【第2版】一部改訂版 ver.2.2(2018年10月)より作成
http://www.jsco-cpg.jp/item/29/index.html(2022年5月閲覧)
表3 大腸癌薬物療法に用いる
主なレジメンの催吐性リスク分類

日本癌治療学会: 「制吐薬適正使用ガイドライン」2015年10月【第2版】一部改訂版 ver.2.2(2018年10月)より作成
http://www.jsco-cpg.jp/item/29/index.html(2022年5月閲覧)
がん薬物療法における制吐薬の変遷
がん薬物療法における主な制吐薬の開発の歴史を示します(図1)。
1970年代前半までは、抗ヒスタミン作用と鎮静作用を持つフェノチアジン以外には有効な薬剤はありませんでした1)。
1970年代後半から催吐作用の強いシスプラチンなどが多く用いられるようになると、嘔吐・悪心の発症機序や制吐療法の研究が行われ、1980年代に入るとドパミンD2受容体拮抗薬のメトクロプラミド大量投与がシスプラチンの悪心・嘔吐に有効なことが報告されました。また、デキサメタゾン大量療法やメトクロプラミド大量投与+デキサメタゾン併用療法の優れた制吐効果が報告され、メトクロプラミド大量投与+デキサメタゾン併用療法は、当時の標準的制吐療法とされていました1)。
しかしながら、この併用療法でもシスプラチンのように催吐作用の強い抗がん薬での有効率は50%前後であり、メトクロプラミド大量投与による錐体外路症状、鎮静作用などの副作用が強く、より有効な制吐薬の開発が待たれていました1)。
1990年代になると、グラニセトロン、オンダンセトロン、ラモセトロンなどの第1世代の5-HT3受容体拮抗薬が承認され、さらにデキサメタゾンとの併用療法が急性期の嘔吐・悪心に対して、より効果が高いことが証明されました1)。
しかしながら、第1世代の5-HT3受容体拮抗薬だけでは、遅発期の嘔吐・悪心の制御が不十分であったことから、別の作用機序により制吐作用を発揮するNK1受容体拮抗薬が開発され、2009年に本邦でも承認されました。
5-HT3受容体拮抗薬は、約50%の患者さんの嘔吐・悪心を予防または減少させます。5-HT3受容体拮抗薬にデキサメタゾンを併用すると、その割合は約70%に上昇、さらにNK1受容体拮抗薬を追加すると約84%になると報告されています2)。
さらに、第1世代の5-HT3受容体拮抗薬と比較して5-HT3受容体との高い親和性かつ半減期の長い、遅発期の嘔吐・悪心に抑制効果を示す第2世代の5-HT3受容体拮抗薬であるパロノセトロンが開発されました。
現在では、がん薬物療法時の悪心・嘔吐は制御できる副作用と考えられるようになってきています。しかしながら、一方では、確立された支持療法を行っても少なからず嘔吐が起こる患者さんがいること、また悪心を完全には制御できていないことが課題として残っています。
- 佃 守:Biotherapy. 2011; 25(3): 680-688.
- Navari RM, et al.: N Engl J Med. 2016; 374(14): 1356-1367.
図1 がん薬物療法における悪心・嘔吐に用いられる
主な制吐薬の承認年および制吐療法の変遷

各薬剤のインタビューフォーム、佃 守:Biotherapy. 2011; 25(3): 680-688より作成
がん薬物療法における
制吐療法のダイアグラム
「制吐薬適正使用ガイドライン」には、各催吐性リスクに対する制吐療法が、制吐薬(NK1受容体拮抗薬、5-HT3受容体拮抗薬、デキサメタゾン)の用量も含めたダイアグラムとしてわかりやすく示されています。
高度催吐性リスクの注射抗がん薬を使用する場合には、NK1受容体拮抗薬であるアプレピタント経口投与あるいはホスアプレピタント静脈内投与、5-HT3受容体拮抗薬およびデキサメタゾンの3剤併用が推奨されています(図2(a))。
中等度催吐性リスクの注射抗がん薬を使用する場合は、5-HT3受容体拮抗薬とデキサメタゾンの2剤併用が推奨されています。ただし、カルボプラチンなど一部の抗がん薬を含むレジメンを用いる場合は、2剤に加えてNK1受容体拮抗薬の併用が推奨されています(図2(b))。
軽度催吐性リスクの注射抗がん薬を使用する場合は、抗がん薬投与前にデキサメタゾン3.3〜6.6mgを単独で静注し、状況に応じてプロクロルペラジンまたはメトクロプラミドを投与します。
最小度催吐性リスクに対しては、基本的に予防的な制吐療法は推奨されていません。
図2 制吐療法のダイアグラム
(a) 高度催吐性リスクの注射抗がん薬に対する制吐療法

(b) 中等度催吐性リスクの注射抗がん薬に対する制吐療法
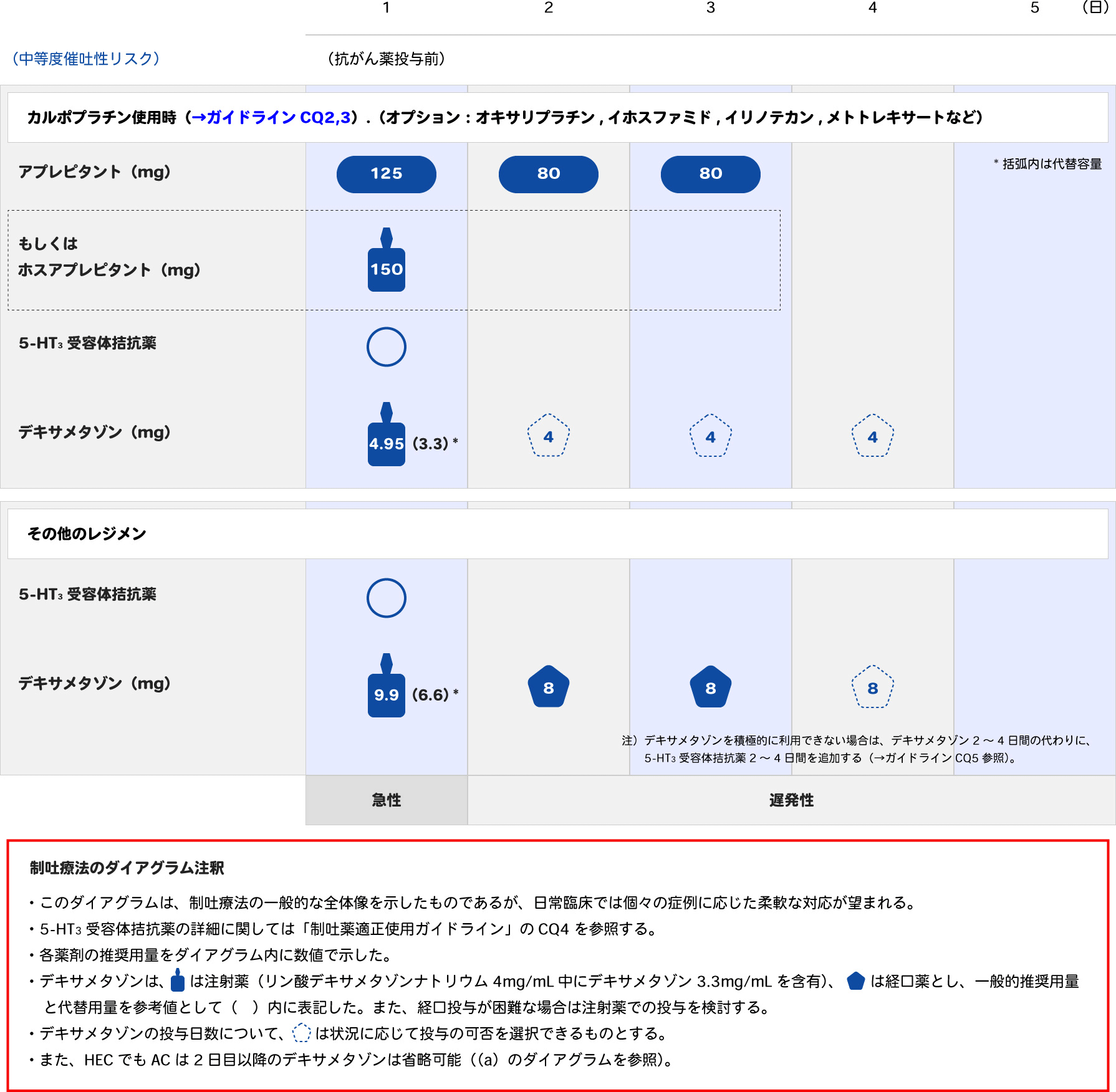
日本癌治療学会: 「制吐薬適正使用ガイドライン」2015年10月【第2版】一部改訂版 ver.2.2(2018年10月)より引用
http://www.jsco-cpg.jp/item/29/index.html(2022年5月閲覧)
その他の制吐療法
近年では、前述の基本的な制吐療法の他に、オランザピンの効果とsteroid sparing(ステロイド・スペアリング)についても検討がなされています。
高度催吐性リスク抗がん薬による嘔吐・悪心に対して、NK1受容体拮抗薬、5-HT3受容体拮抗薬、デキサメタゾンの3剤にオランザピンを上乗せすることで嘔吐完全抑制率※1が上昇することが報告されています1)(図3)。
またオランザピンは、パロノセトロンとデキサメタゾン併用下においてアプレピタントを用いた場合と同程度の嘔吐完全抑制率※1を示すことも報告されています2)。
ただし、オランザピンは糖尿病の患者さんには禁忌であり、眠気などにも注意が必要です。
「制吐薬適正使用ガイドライン」では、推奨用量や使用方法についてはいまだ検証中であるため、適切な患者さんへの慎重な投与を求めています。
steroid sparingとは、ステロイドの副作用(血糖上昇、不眠、消化性潰瘍、骨量低下など)を減ずる目的で2日目以降の内服ステロイド(デキサメタゾン)を省略することを指します。
糖尿病など、ステロイドの使用を避けるべき患者さんにおいて、steroid sparingが考慮されることもあります。
乳癌薬物療法で使用されるアントラサイクリン+シクロホスファミド併用(AC)療法において、steroid sparingとステロイド通常使用に対する非劣性が示されており、AC療法においては、 steroid sparingは選択肢の1つとなります3)。中等度リスク抗がん薬においてもsteroid sparingが可能であったとの報告もあります4)。
ただし、これらの報告で使用された5-HT3受容体拮抗薬はパロノセトロンのみであることに注意が必要です。
- Hashimoto H, et al.: Lancet Oncol. 2020; 21(2): 242-249.
- Navari RM, et al.: J Support Oncol. 2011; 9(5): 188-195.
- Ito Y, et al.: J Clin Oncol. 2018; 36(10): 1000-1006.
- Komatsu Y, et al.: Cancer Sci. 2015; 106(7): 891-895.
※1 嘔吐完全抑制率:嘔吐・悪心がなく、追加の制吐剤の投与を必要としない状態を達成した患者の割合
図3 3剤にオランザピンを上乗せした場合の
嘔吐完全抑制率の報告
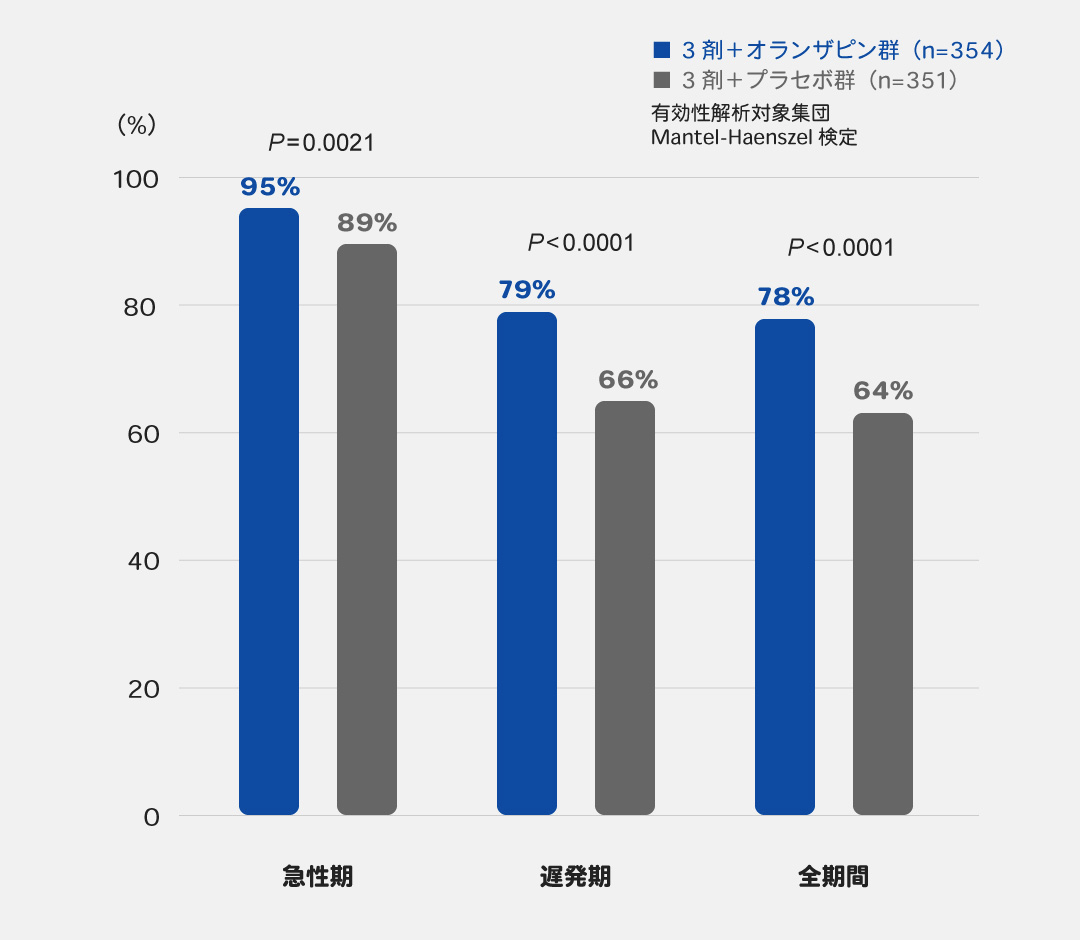
目的・対象:血液がんを除く悪性腫瘍の初回治療として、シスプラチン(≧50mg/m2)を含むがん薬物療法を行う患者710例を対象とし、遅発期の制吐を目的として5-HT3受容体拮抗薬、NK1受容体拮抗薬およびデキサメタゾンの3剤を用いる併用療法に対するオランザピン5mgを上乗せした4剤併用療法の優越性を検討した国内第Ⅲ相二重盲検無作為化試験。
方法:患者710例を3剤併用療法を行う3剤+プラセボ群(354例)、オランザピンを上乗せした3剤+オランザピン群(356例)に無作為(1:1)に割り付けた。両群は、シスプラチン投与日(Day1)に、5-HT3受容体拮抗薬としてパロノセトロン0.75mg、NK1受容体拮抗薬としてアプレピタント125mgまたはホスアプレピタント150mgを投与した。アプレピタントを用いる場合は、Day2, 3にアプレピタント80mgを投与し、デキサメタゾンをDay1に12mg、Day2~4に8mgを投与した。ホスアプレピタントを用いる場合は、Day3, 4にデキサメタゾン16mgを投与した。これに加えて、3剤+プラセボ群ではプラセボ、3剤+オランザピン群ではオランザピン5mgをDay1~4の夕食後に投与した。
解析方法:主要評価項目は遅発期(シスプラチン投与後24~120時間後)の嘔吐完全抑制率とし、副次評価項目は急性期(シスプラチン投与後0~24時間後)の嘔吐完全抑制率、全期間(シスプラチン投与後0~120時間後)の嘔吐完全抑制率とした。群間差は年齢・性別・シスプラチンの投与量の割付調整因子で調整したMantel-Haenszel検定により評価した。
Hashimoto H, et al.: Lancet Oncol. 2020; 21(2): 242-249より作成
薬剤師の皆さんへ
薬剤師の皆さんが基本的な制吐薬の使い方を理解することはとても重要です。
制吐薬の組み合わせを知ることで、患者さんがどの催吐性リスクの抗がん薬が使われているかを予測することができます。
また、エビデンスに基づいた制吐療法を行っても悪心・嘔吐が起こる患者さんが少なからずいます。
悪心・嘔吐を評価する客観的なものさしとして、CTCAE v5.0による悪心・嘔吐のGrade評価を示します(表4)。
電話などでのフォローアップ時や来局時に悪心・嘔吐が制御できていない患者さんに出会ったら、ぜひCTCAEでGrade評価をし、処方医や病院薬剤部にフィードバックをお願いします。
表4 悪心・嘔吐の重症度評価(CTCAE)

有害事象共通用語規準 v5.0 日本語訳JCOG版より引用、改変
JCOGホームページ http://www.jcog.jp(2022年5月閲覧)
参考:PRO-CTCAE®
近年では、患者さん自身による主観評価も重要視されてきています。
がん臨床試験における患者さんの自己評価に基づき、 有害事象評価の正確性と高い精度のグレーディングを追求したツールとしてPRO-CTCAE®が公開されていますので、参考として示します(表5)。
患者さんの自己評価であるPRO-CTCAE®と、医療関係者による客観的評価であるCTCAEは直接的に対応していないため、PRO-CTCAE®を使用する際にはCTCAEの項目を同時期に評価することが推奨されています。
PRO-CTCAE®は、これから患者さん自身が有害事象を評価する手法として普及していくと思われます。
表5 PRO-CTCAE® : 吐き気・嘔吐

NCI-PRO-CTCAE® ITEMS-JAPANESE Item Library Version 1.0より引用
https://healthcaredelivery.cancer.gov/pro-ctcae/pro-ctcae_japanese.pdf(2022年5月閲覧)
各抗がん薬の催吐性リスク分類については、日本癌治療学会の「制吐薬適正使用ガイドライン」2015年10月【第2版】一部改訂版 ver.2.2(2018年10月)を参照ください。
当コンテンツの情報および監修者の所属・役職は掲載日時点での情報となります。
また、当該医薬品の使用に当たっては、最新の添付文書、ガイドライン等をあわせてご参照くださいますようお願いします。
