薬剤師のためのBasic Evidence(乳癌編)
掲載日:2023年3月30日
更新日:2025年7月29日

原 文堅 先生
愛知県がんセンター
乳腺科部 部長
本邦における乳癌の罹患数は、2021年時点、女性では第1位です。また、死亡数は2023年現在、女性では第4位と、罹患数、死亡数ともに高い割合を占めています1)。
乳癌の治療は、主に手術療法、放射線療法、薬物療法があり、病期(Stage)や癌の性質、患者さんの全身状態や希望などを考慮して決定されます。
「薬剤師のためのBasic Evidence(乳癌編)」では、乳癌の薬物療法の概要がつかめるよう、2022年に改訂された「乳癌診療ガイドライン 2022年版」に準拠した、「病期による治療の流れ」、「乳癌の薬物療法」の基礎的な内容をご紹介します。
乳癌の患者さんの70~80%はホルモン受容体陽性で2)、その多くは術後内分泌療法を受けています。そのため、薬物療法の中でも「術後内分泌療法」について取り上げ、術後内分泌療法における診療ガイドライン2022年版の改訂ポイントと併せて解説します。
- 国立がん研究センター:がん情報サービス 最新がん統計
https://ganjoho.jp/reg_stat/statistics/stat/summary.html (2025年7月閲覧) - 日本乳癌学会 編「患者さんのための乳がん診療ガイドライン 2023年版 第7版」 金原出版株式会社
目次
- 乳癌の病期による治療の流れ
- 乳癌の薬物療法
- 乳癌の性質による薬物療法の選択
- 乳癌の内分泌療法
- 術後薬物療法(術後内分泌療法)
- 乳癌診療ガイドライン①治療編2022年版 改訂のポイント
- 内分泌療法における主な副作用
- 薬剤師の皆さんへ
各製剤の詳細は電子添文をご参照ください。
乳癌の病期による治療の流れ
乳癌の病期は、腫瘍の大きさや広がり、周辺のリンパ節転移の状況、遠隔転移の有無によって分類されます。
乳癌細胞が乳管内にとどまっている非浸潤性乳管癌(Stage0)では、局所療法(手術±放射線療法)を行います。Stage0以外の早期乳癌(StageⅠ~ⅢA)では、局所療法(手術±放射線療法)と、全身療法(薬物療法)を行います。薬物療法は、術後に行うことが多いですが、状況によっては術前に行うこともあります。局所進行乳癌(StageⅢB、ⅢC)では、薬物療法を行ってから局所療法(手術+放射線療法)を行うことが一般的です。転移・再発乳癌(StageⅣ)では、薬物療法を中心として集学的治療を行います(図1)。
図1 病期による治療の流れ
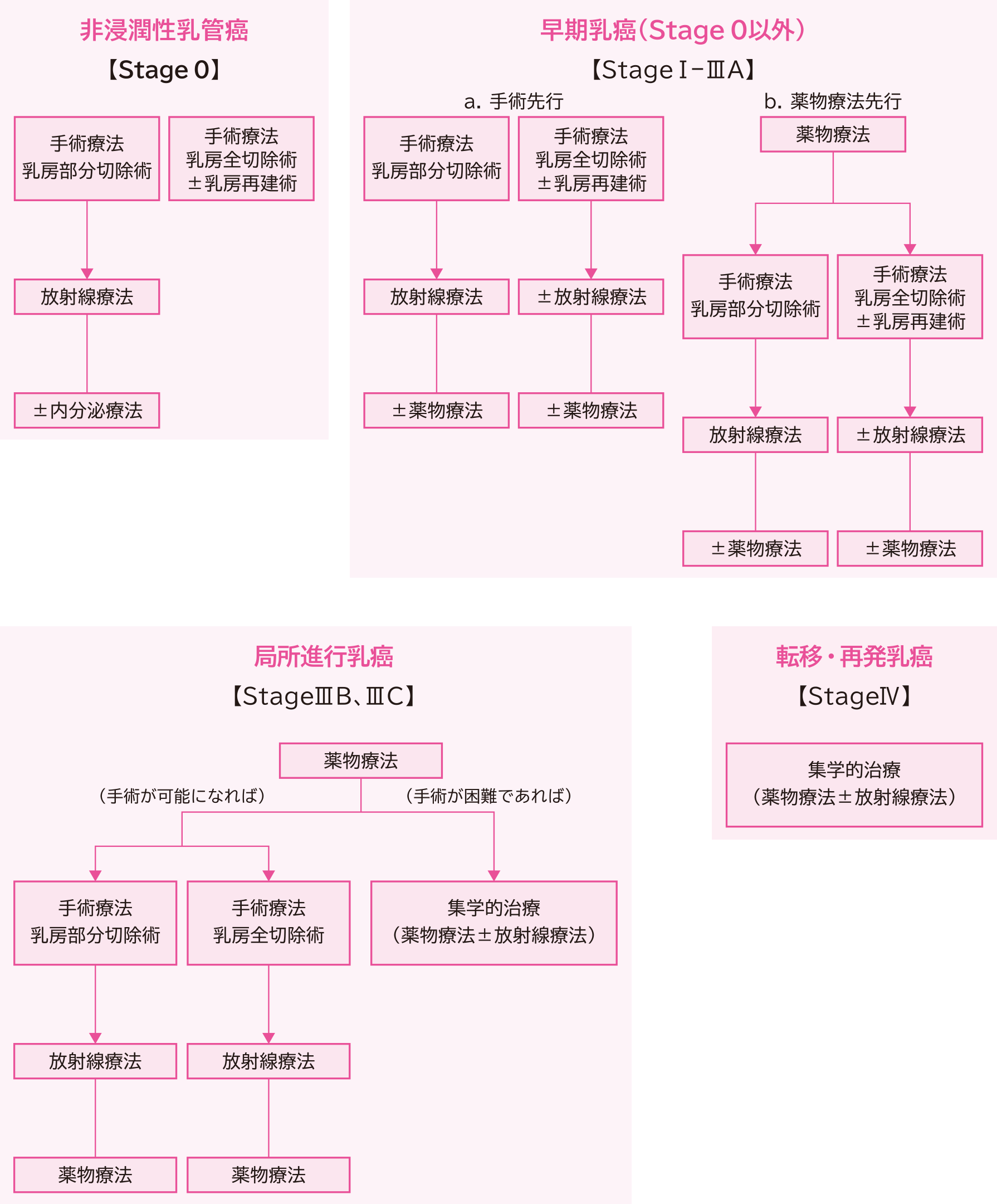
日本乳癌学会 編「乳癌診療ガイドライン ①治療編 2022年版」 金原出版株式会社、2022、p.15,17,41 より改変
乳癌の薬物療法
薬物療法には、術前薬物療法、術後薬物療法、転移・再発乳癌に対する薬物療法があります。術前薬物療法の目的は病期によって異なっており、早期乳癌では、微小転移の根絶・抑制、乳房部分切除術、あるいは残存病変に基づく治療選択のために行います。局所進行乳癌では、ダウンステージングのために行います。術後薬物療法の目的は、微小転移の根絶・抑制です。転移・再発乳癌に対する薬物療法は、延命や生活の質(QOL)の維持・改善を目的として行います(表1)。
表1 乳癌の薬物療法

日本乳癌学会 編「乳癌診療ガイドライン ①治療編 2022年版」 金原出版株式会社、2022 より作成
乳癌の性質による
薬物療法の選択
薬物療法には、内分泌療法(ホルモン療法)、化学療法、分子標的療法、免疫療法があり、ホルモン受容体やHER2蛋白発現の状況によって分類されるサブタイプ分類(表2)、治療効果予測因子、予後予測因子(表3)による再発リスク、患者さんの全身状態や希望、年齢、閉経状況などを考慮して使用する薬剤を決定します。
生検や手術で採取された組織を用いた病理検査でホルモン受容体、HER2、PD-L1発現などの治療効果予測因子を調べて、内分泌療法、抗HER2療法、免疫チェックポイント阻害薬の適応を確認します。
化学療法は、ホルモン受容体陰性HER2陰性のトリプルネガティブ乳癌や、抗HER2療法および免疫チェックポイント阻害薬を使用する場合の併用に用いられます。また、腋窩リンパ節転移の有無や腫瘍径などによる再発リスクや、ホルモン受容体陽性HER2陰性乳癌で対象となる場合は多遺伝子アッセイの結果に基づいて使用を検討します(表3)。
表2 サブタイプ分類

日本乳癌学会 編「乳癌診療ガイドライン ➁疫学・診断編 2022年版」 金原出版株式会社、2022 より作成
表3 治療効果予測因子と予後予測因子
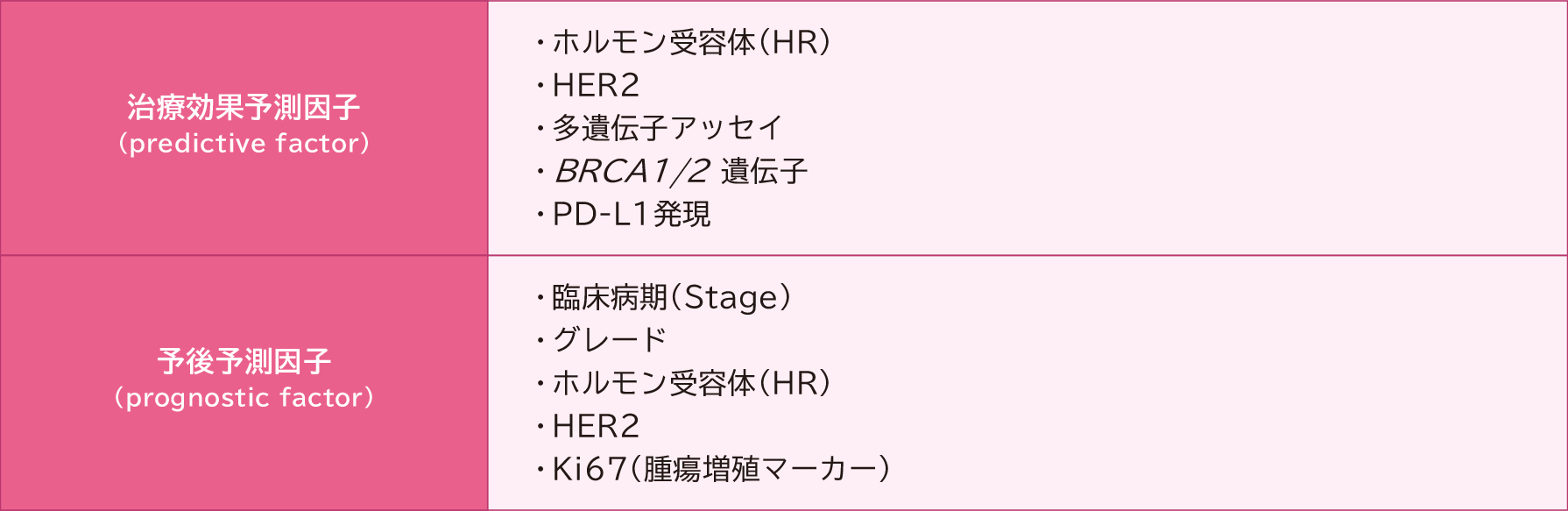
日本乳癌学会 編「乳癌診療ガイドライン ①治療編 2022年版」 金原出版株式会社、2022 より作成
乳癌の内分泌療法
乳癌の発生・増殖にはエストロゲンが必要であるという認識は、1896年にBeatsonよって進行乳癌に対して卵巣摘出術が有効であったと報告したことから広まり始めました3)。
ホルモン受容体陽性乳癌では、エストロゲンが乳癌細胞のエストロゲン受容体(ER)に結合することによって増殖するため、内分泌療法を行います。内分泌療法は、術後の再発予防を目的とした術後薬物療法と、転移・再発乳癌の延命やQOLの維持・改善を目的とした薬物療法に用いられます。
図2 閉経前のエストロゲンの供給経路
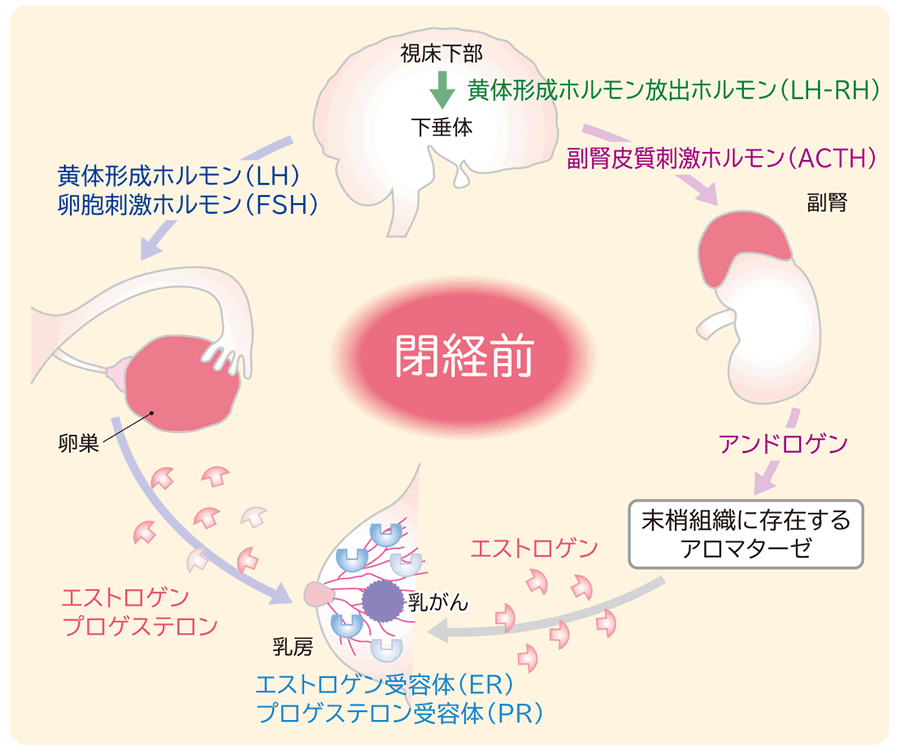
図3 閉経後のエストロゲンの供給経路
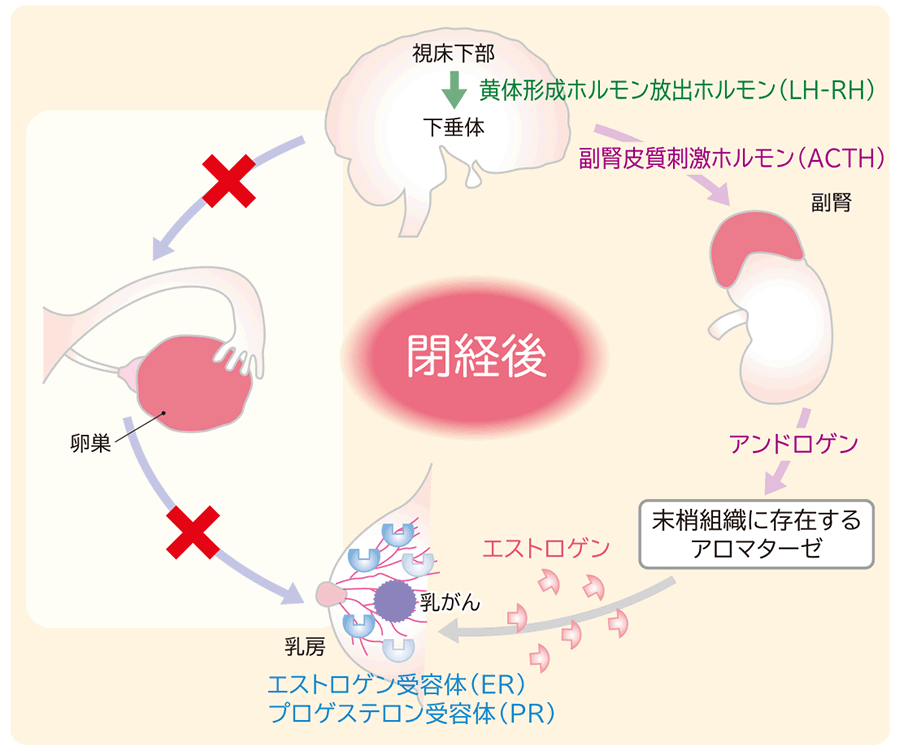
「がん治療の薬理学 図でわかるメカニズム」(メディカル・サイエンス・インターナショナル)より作成
内分泌療法は、閉経前後でエストロゲンの供給経路が変わるため、閉経状況によって治療方法が異なります。
閉経前女性では、脳の視床下部から下垂体に黄体形成ホルモン放出ホルモン(LH-RH)が分泌され、下垂体から黄体形成ホルモン(LH)と卵胞刺激ホルモン(FSH)が産生されます。これらの刺激を受けて卵巣からエストロゲンとプロゲステロンが分泌され、乳癌細胞のエストロゲン受容体(ER)・プロゲステロン受容体(PR)に結合することにより、乳癌細胞が増殖します(図2)。そのため、下垂体におけるLH、FSHの生成を抑制することで卵巣からのエストロゲン生成を抑制するLH-RHアゴニスト(ゴセレリン、リュープロレリン)、エストロゲン受容体に作用してエストロゲンが受容体に結合するのを阻害する抗エストロゲン薬(タモキシフェン、フルベストラント)が治療に用いられます。
閉経後女性では、卵巣機能が低下するため、脳下垂体からの副腎皮質刺激ホルモン(ACTH)の刺激を受けて副腎皮質から分泌されるアンドロゲンが、脂肪などの末梢組織に存在するアロマターゼによってエストロゲンに変換されます(図3)。そのため、アロマターゼを阻害するアロマターゼ阻害薬(アナストロゾール、レトロゾール、エキセメスタン)が主に治療に用いられます。また、抗エストロゲン薬(タモキシフェン、トレミフェン、フルベストラント)を治療に用いることもあります。
3)Beatson GT:Trans Med Chir Soc Edinb 1896; 15: 153-179.
術後薬物療法
(術後内分泌療法)
①閉経前
再発リスクが低い場合には、タモキシフェン単剤を使用します。2011年のEBCTCG(Early Breast Cancer Trialists’ Collaborative Group)のメタアナリシスでは、タモキシフェン5年間投与は投与なしと比較して、治療開始から15年間の再発を39%抑制し(n=10,645、RR(リスク比)0.61、95%CI(信頼区間) 0.57-0.65、p<0.00001*)、死亡率を30%抑制しました(n=10,645、RR 0.70、95%CI 0.64-0.75、p<0.00001*) 4)。また、再発・転移のリスクが高い場合には、タモキシフェンとLH-RHアゴニストの併用、もしくは、LH-RHアゴニストとアロマターゼ阻害薬(保険適用外)の併用を行う場合もあります。特に若年女性では卵巣からのエストロゲン産生が多いため、卵巣機能を抑制してエストロゲンの分泌を閉経後状態にするためにLH-RHアゴニストを使用します。
また、後述しますが、再発リスクが高い場合には、内分泌療法にS-1を1年間併用あるいはアベマシクリブを2年間併用することが推奨されています。
*log rank検定
➁閉経後
閉経後ホルモン受容体陽性乳癌に対する術後内分泌療法としては、アロマターゼ阻害薬を使用します。閉経後においても以前は、標準的な内分泌療法はタモキシフェン5年間内服でした。アロマターゼ阻害薬の有用性は、2015年にEBCTCGによるメタアナリシスが報告されており、アロマターゼ阻害薬5年間の内服は、タモキシフェン5年間の内服と比較して、10年間の乳癌再発を20%減少させ(n=9,885、RR 0.80、95%CI 0.73-0.88、p<0.00001*)、乳癌死亡を15%減少させました(n=9,885、RR 0.85、95%CI 0.75-0.96、p=0.009*)5)。そのため、閉経後ホルモン受容体陽性乳癌では、一般的にアロマターゼ阻害薬を使用しますが、副作用等で使用できない場合は、タモキシフェンを用います。
現在本邦で広く使用されているアロマターゼ阻害薬には、アナストロゾール、レトロゾール、エキセメスタンがありますが、これらの薬剤間における有効性に差はないと考えられています6)。
こちらも閉経前と同様に、再発リスクが高い場合には、内分泌療法にS-1を1年間併用あるいはアベマシクリブを2年間併用することが推奨されています。
*log rank検定
4)Davies C, et al.: Lancet. 2011; 378(9793): 771-784.
5)EBCTCG:Lancet. 2015; 386(10001): 1341-1352.
6)Goss PE, et al.: J Clin Oncol. 2013; 31(11): 1398-1404.
③5年間の内分泌療法後の追加投与について
【タモキシフェン】
タモキシフェン5年間投与終了後の早期乳癌症例を対象に、タモキシフェン5年間追加投与群と経過観察群を比較する大規模ランダム化比較試験が行われました。aTTom試験とATLAS試験の統合解析(n=17,744)7)の結果、乳癌死亡をRR 0.85(95%CI 0.77-0.94、p=0.001)と減少させましたが、子宮体癌、静脈血栓症・肺血栓塞栓症の発症リスクは上昇するため、再発リスクの高い早期乳癌等が適応になります。
【アロマターゼ阻害薬】
アロマターゼ阻害薬も同様に、2~5年追加投与の有用性が報告されました。乳癌診療ガイドライン2022年版では、内分泌療法終了後のアロマターゼ阻害薬の追加投与について検討したランダム化比較試験のメタアナリシスが報告されています8)。メタアナリシスの結果*、内分泌療法5年投与終了後、アロマターゼ阻害薬2~5年追加投与により、無病生存期間(DFS)(n=15,052、HR(ハザード比) 0.65、95%CI 0.57-0.74、p<0.00001)は有意に改善し、全生存期間(OS)(n=13,490、HR 0.85、95%CI 0.71-1.04、p=0.11)も改善傾向を認めましたが有意差は認められませんでした。骨痛や骨粗鬆症などの有害事象も更に増加するため、再発リスクと有害事象を考慮して、追加投与を行うかどうか判断します。
7)Schiavon G, et al.: Breast Cancer Res. 2014; 16(2): 206.
8)日本乳癌学会 編「乳癌診療ガイドライン ①治療編 2022年版」 金原出版株式会社、2022
乳癌診療ガイドライン①
治療編2022年版 改訂のポイント
4年ぶりに乳癌診療ガイドラインが全面改訂され、薬物療法では、早期乳癌の術後療法におけるエスカレーション治療、残存病変の有無に基づく治療選択、免疫療法による周術期治療、閉経前転移・再発乳癌に対するCDK4/6阻害薬について6つのCQが新設されました。
早期乳癌に対するエスカレーション治療については、ホルモン受容体陽性HER2陰性乳癌に対する術後のS-1とアベマシクリブについて2つのCQが新設されました。
①S-1について
StageⅠ-ⅢBの再発リスクが中等度または高度のホルモン受容体陽性HER2陰性の乳癌患者1,930人を対象とし、術後内分泌療法5年間に対して、経口S-1内服投与追加の意義を検証した国内多施設共同非盲検ランダム化第Ⅲ相比較試験(POTENT試験)が行われました9)。 S-1併用群はS-1を80~120mg/日を1日2回、14日間連続経口投与し、7日間休薬することを1コースとし、1年間投与されました。
主要評価項目であるIDFS(浸潤病変のない生存期間)は、追跡期間中央値52.2ヵ月時点で、 HR 0.63(95%CI 0.49~0.81、p=0.0003*)と S-1併用群で有意に改善していました。
S-1併用群に多く発現したGrade3以上の有害事象としては、好中球減少(8%)、下痢(2%)、白血球減少(2%)、ビリルビン値上昇(1%)、倦怠感(<1%)などでした。
以上より、S-1はPOTENT試験の結果に基づきホルモン受容体陽性HER2陰性乳癌に対する術後療法として、乳癌診療ガイドライン①治療編2022年版(CQ5)において、「再発リスクが高い場合、内分泌療法にS-1を1年間併用することを強く推奨する。」とされています。
*log rank検定
9)Toi M, et al.: Lancet Oncol. 2021; 22(1): 74-84.

日本乳癌学会 編「乳癌診療ガイドライン ①治療編 2022年版」 金原出版株式会社、2022、p.75 より許諾を得て転載
②アベマシクリブについて
アベマシクリブについては、再発リスクの高いホルモン受容体陽性HER2陰性乳癌患者5,637人を対象として、術後内分泌療法5~10年に対して、アベマシクリブの追加投与の意義を検証した、多施設共同非盲検ランダム化第Ⅲ相試験(monarchE試験)が行われました10)。アベマシクリブ併用群はアベマシクリブ150mg/日を1日2回、連日2年間投与しました。
主要評価項目であるIDFS(コホート1&2*1)は、1回目の追加解析である経過観察中央値27ヵ月時点で、HR 0.70(95%CI 0.59-0.82、p<0.0001 *2)と有意に改善し、3年IDFSは併用群88.8%、内分泌療法単独群83.4%と5.4%の上乗せ効果が報告されました11)。
有害事象としては、Grade3以上の有害事象の発現は、アベマシクリブ併用群で多く、頻度の高いものとして、下痢(83.5%)、好中球減少(45.8%)、疲労感(40.6%)などでした。
以上より、アベマシクリブはホルモン受容体陽性HER2陰性乳癌に対する術後療法として、乳癌診療ガイドライン①治療編2022年版(CQ6)において、 「再発リスクが高い場合、内分泌療法にアベマシクリブを2年間併用することを強く推奨する。」とされています。
なお、本邦での術後療法としてのアベマシクリブはmonarchE試験におけるコホート1*1の適格基準で承認されています。
POTENT試験とmonarchE試験の組み入れ対象となった患者には重複する部分と重複しない部分があります。重複する場合には、治療効果だけではなく、投与期間の違いや安全性プロファイル、患者さんの希望を考慮して決めることが大切です。
*1 monarchE試験の適格基準
コホート1:①腋窩リンパ節転移4個以上の患者、もしくは➁腫瘍径5cm以上、組織学的グレード3のいずれかを満たす腋窩リンパ節転移1~3個の患者
コホート2:①腋窩リンパ節転移1~3個、腫瘍径5cm未満、組織学的グレード1または2、中央判定でのKi67評価≧20%のすべてを満たす患者
*2 log rank検定
10)Johnston SRD, et al.: J Clin Oncol. 2020; 38(34): 3987-3998.
11)Harbeck N,et al.: Ann Oncol. 2021; 32(12)1571-1581.

日本乳癌学会 編「乳癌診療ガイドライン ①治療編 2022年版」 金原出版株式会社、2022、p.78 より許諾を得て転載
内分泌療法における主な副作用
内分泌療法の副作用は、主にエストロゲンの作用を抑制することによって起こり、ほてり、発汗、動悸などの更年期様症状があります。薬剤別では、タモキシフェンでは、更年期様症状、特にホットフラッシュが高頻度にみられます。また、深部静脈血栓症と子宮内膜癌のリスク増加にも注意が必要です。アロマターゼ阻害薬の副作用として、手指の関節のこわばりを代表とする関節症状が高頻度に起こります。また、骨粗鬆症を誘発することがあり、特に骨密度が下がっている患者さんに使用する場合、骨粗鬆症対策が重要となります。
化学療法と比較すると副作用も軽いと思われがちですが、投与期間が5~10年間と長期に及ぶ場合もあり、発生リスクやその管理等について理解を深める必要があります。
薬剤師の皆さんへ
薬剤師の皆さんが各疾患の基本的な治療方針を理解することはとても重要です。治療方針を知ることで、注意すべき副作用を想定しながら服薬指導にあたることができます。
乳癌の薬物療法では、タモキシフェンやアロマターゼ阻害薬、S-1、アベマシクリブなどの内服薬が院外処方されることがあります。また内分泌療法は、投与期間が長期に及びます。長期間の服用を続けることで再発リスクを抑制できることは当コンテンツでお伝えした通りです。そのため、患者さんのアドヒアランスが重要となり、服薬指導を行う保険薬局薬剤師においても、患者さんの服薬継続のためのフォローアップが重要になります。
ぜひ、この「薬剤師のためのBasic Evidence(乳癌編)」および「診療現場最前線」を使って勉強してみてください。
当コンテンツの情報および監修者の所属・役職は掲載日時点での情報となります。
また、当該医薬品の使用に当たっては、最新の添付文書、ガイドライン等をあわせてご参照くださいますようお願いします。
