薬剤師のためのBasic Evidence(大腸癌編)Vol. 2
掲載日:2022年8月17日

加藤 健 先生
国立がん研究センター中央病院
消化管内科、頭頸部・食道内科 科長

平野 秀和 先生
国立がん研究センター中央病院
消化管内科
大腸癌の薬物療法は長きにわたってフッ化ピリミジン系薬などの殺細胞性抗癌薬を中心にレジメンが組み立てられていましたが、近年、分子標的治療薬や免疫チェックポイント阻害薬など、新しい作用機序を有する薬剤が登場し、標準治療として使用されるようになってきています。
「薬剤師のためのBasic Evidence Vol. 2」では切除不能進行・再発大腸癌の一次治療で使用される代表的なレジメンとその背景を解説しています。
レジメンの背景を知ることにより、安全性上の留意点への理解を深めることができます。レジメンへの理解を深め、患者さんに寄り添った適切な指導を目指しましょう。
Vol. 1では「大腸癌治療ガイドライン 医師用2022年版」から切除不能進行・再発大腸癌の薬物療法の選択基準や治療アルゴリズムなどについて紹介しました。
Vol. 2では、この治療アルゴリズムの一次治療のうち、当院で使用頻度の高いFOLFOX+ベバシズマブ併用療法、CAPOX+ベバシズマブ併用療法、FOLFIRI+ベバシズマブ併用療法を取り上げ、大腸癌治療ガイドライン掲載の根拠となった臨床試験の結果や服薬指導時の注意点をご紹介します。
Vol. 1で解説したように、これらの薬物療法は、一次治療の併用療法の忍容性に問題がないFitに分類される患者さんのうち、RAS、BRAF遺伝子ともに変異がなく、かつ腫瘍占居部位が右側の患者さん、およびRAS、BRAF遺伝子のいずれかに変異を持つ患者さんに使用されます。
目次
- FOLFOX+BEV併用療法
- FOLFOX+BEV併用療法の臨床試験
- FOLFOX+BEV併用療法における服薬指導時の注意点
- CAPOX+BEV併用療法
- CAPOX+BEV併用療法の臨床試験
- CAPOX+BEV併用療法における服薬指導時の注意点
- FOLFIRI+BEV併用療法
- FOLFIRI+BEV併用療法の臨床試験
- FOLFIRI+BEV併用療法における服薬指導時の注意点
- 薬剤師の皆さんへ
各製剤の詳細は電子添文をご参照ください。
FOLFOX+BEV併用療法
FOLFOXは、フルオロウラシル(5-FU)、レボホリナート(l-LV)、オキサリプラチン(OX)を組み合わせた薬物療法であり、 2000年代以降、広く行われてきました。現在では、分子標的治療薬であるベバシズマブ(BEV)を組み合わせた併用療法が標準治療となっています。FOLFOXには、投与量や投与方法の異なるレジメンがいくつかあり、後ほど紹介する臨床試験①では投与サイクルの1日目、2日目に5-FUの急速静注と持続静注を行うFOLFOX4を行っていますが、急速静注を1日目のみに行い、46時間かけて持続静注を行うmFOLFOX6が国内では広く用いられています。
表1に当院で採用しているmFOLFOX6+BEVのレジメンを例として示しました。当院では基本的に外来で治療を行います。また、FOLFOXでは、血液毒性や消化器障害などの副作用があらわれる場合があり、重症度に応じて、表2のように減量します。
使用する薬剤の本邦で承認された投与量・投与時間などについては、各薬剤の添付文書を参照してください。レジメンは各病院で審査のうえ採択されており、病院により異なるので注意が必要です。ホームページでレジメンを公開している病院もありますので、確認してみましょう。
表1 当院のmFOLFOX6+BEVレジメン
(1コース:14日)
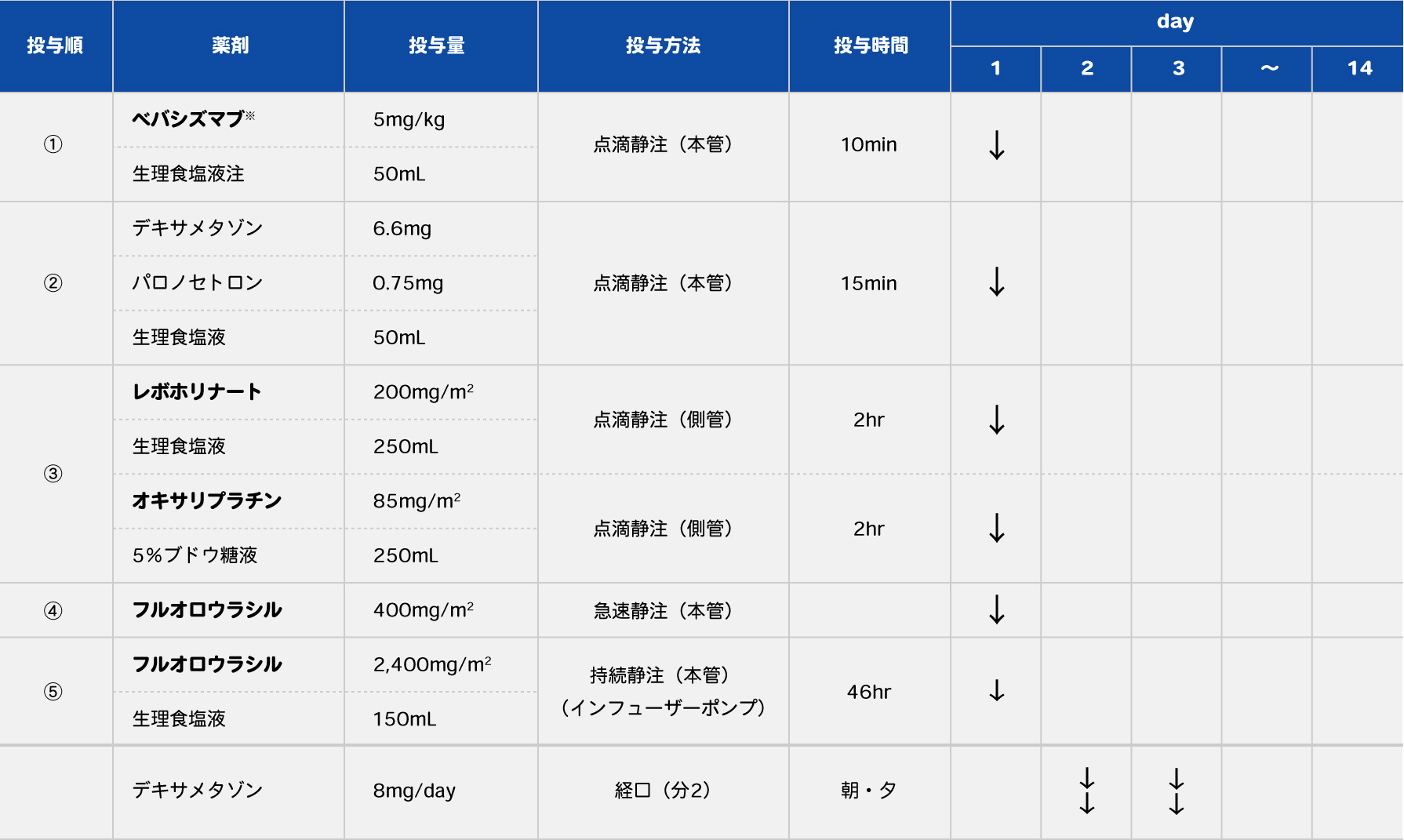
- ※ベバシズマブの投与時間については、Reidy DL, et al.: J Clin Oncol. 2007; 25(19): 2691-2695の試験結果をもとに決定した。本邦で承認されたベバシズマブの投与時間については各薬剤の添付文書を参照。
表2 切除不能進行・再発大腸癌における
FOLFOX減量基準

- ※発熱性好中球減少症が発現した場合は、右の減量基準に従い減量する。
オキサリプラチン点滴静注液50mg・100mg・200mg「NIG」添付文書を参考に作成
FOLFOX+BEV併用療法の臨床試験
「大腸癌治療ガイドライン 医師用2022年版」では、FOLFOXおよびCAPOXにベバシズマブ(BEV)を併用する治療の根拠として、FOLFOX4またはCAPOXに対するBEVの併用療法の優越性を評価した第Ⅲ相試験(臨床試験① NO16966試験)を取り上げています1,2)。
この試験は、切除不能な大腸癌の一次治療における、FOLFOX4に対するCAPOXの非劣性を評価する試験として計画されていましたが、BEVの有効性が報告されたため試験デザインが変更され、非劣性試験に加えて、BEVを追加した併用療法の優越性を評価する試験として実施されました2)。非劣性試験については、CAPOXの有用性の根拠となる試験として、同ガイドラインに取り上げられています。
優越性試験では、無増悪生存期間(PFS)中央値を主要評価項目として、BEVの上乗せ効果を評価しています。その結果、PFS中央値は、化学療法群(FOLFOX4/CAPOX+プラセボ)で8.0ヵ月、BEV併用療法群(FOLFOX4/CAPOX+BEV)で9.4ヵ月であり、BEV併用療法群は化学療法群に対してPFSを有意に延長し(HR 0.83、97.5%CI 0.72-0.95、P=0.0023)、BEV併用療法の優越性が確認されました。
HR: ハザード比、CI: 信頼区間
本試験において、BEV併用療法群では694例中207例(30%)、化学療法群675例中141例(21%)で治験薬投与中止に至り、その主な有害事象は、神経毒性、胃腸障害、一般・全身障害、血液障害によるものでした。
臨床試験①の解析後、4ヵ月間のフォローアップ後に全生存期間の解析とともに安全性についても再度評価しています3)。この解析結果のうち、FOLFOX4+BEV群の有害事象を表3に示します。FOLFOX4+BEV群では、特に神経障害と下痢、悪心、嘔吐、口内炎などの消化器症状が多く発現しています。また、好中球減少症が多いことも特徴です。CAPOX+BEV群の有害事象は表7に示していますので、見比べてみましょう。
- Cassidy J, et al.: J Clin Oncol. 2008; 26(12): 2006-2012.
- Saltz LB, et al.: J Clin Oncol. 2008; 26(12): 2013-2019.
- Cassidy J, et al.: Br J Cancer. 2011; 105(1): 58-64.
表3 FOLFOX4+BEV群の有害事象(n=342)

- ※Grade3のみ
Cassidy J, et al.: Br J Cancer. 2011; 105(1): 58-64より許可を得て転載
臨床試験❶(海外データ) 試験概要
目的・対象:本試験(NO16966試験1,2))は未治療の切除不能大腸癌患者634例を対象として、 FOLFOX4に対するCAPOXの非劣性を評価する非盲検2群比較試験として開始されたが、その後、対象患者1,400例を追加し、これらの化学療法に対するBEV併用療法の優越性を評価する2×2要因試験に変更された。
方法・試験デザイン:優越性試験は、対象患者を無作為化し、FOLFOX4+プラセボ群、CAPOX+プラセボ群、FOLFOX4+BEV群、CAPOX+BEV群に1:1:1:1で割付けた二重盲検2×2要因試験であり、ITT集団1,400例において、BEV併用療法群(FOLFOX4/CAPOX+BEV群 699例)と化学療法群(FOLFOX4/CAPOX+プラセボ群 701例)の統合解析を行った。非劣性試験では、FOLFOX4群、CAPOX群に1:1に無作為化した非盲検2群比較試験の患者(各317例)も組み入れ、FOLFOX4群(FOLFOX4/FOLFOX4+プラセボ/FOLFOX4+BEV 1,017例)とCAPOX群(CAPOX/CAPOX+プラセボ/CAPOX+BEV 1,017例)の統合解析を行った。各群の投与は下図のように実施し、両試験とも主要評価項目としてPFSを評価した。
解析計画:両試験の主要評価項目であるPFSは、カプランマイヤー法を用いて推定した。HRと97.5%CIはCOX比例ハザードモデルを用いて推定した。非劣性試験では、HRの97.5%CIの上限値が事前に設定した非劣性マージン1.23を下回れば、非劣性が証明されることとした。優越性試験では、両側2.5%を有意水準とした層別ログランク検定により群間比較を行った。
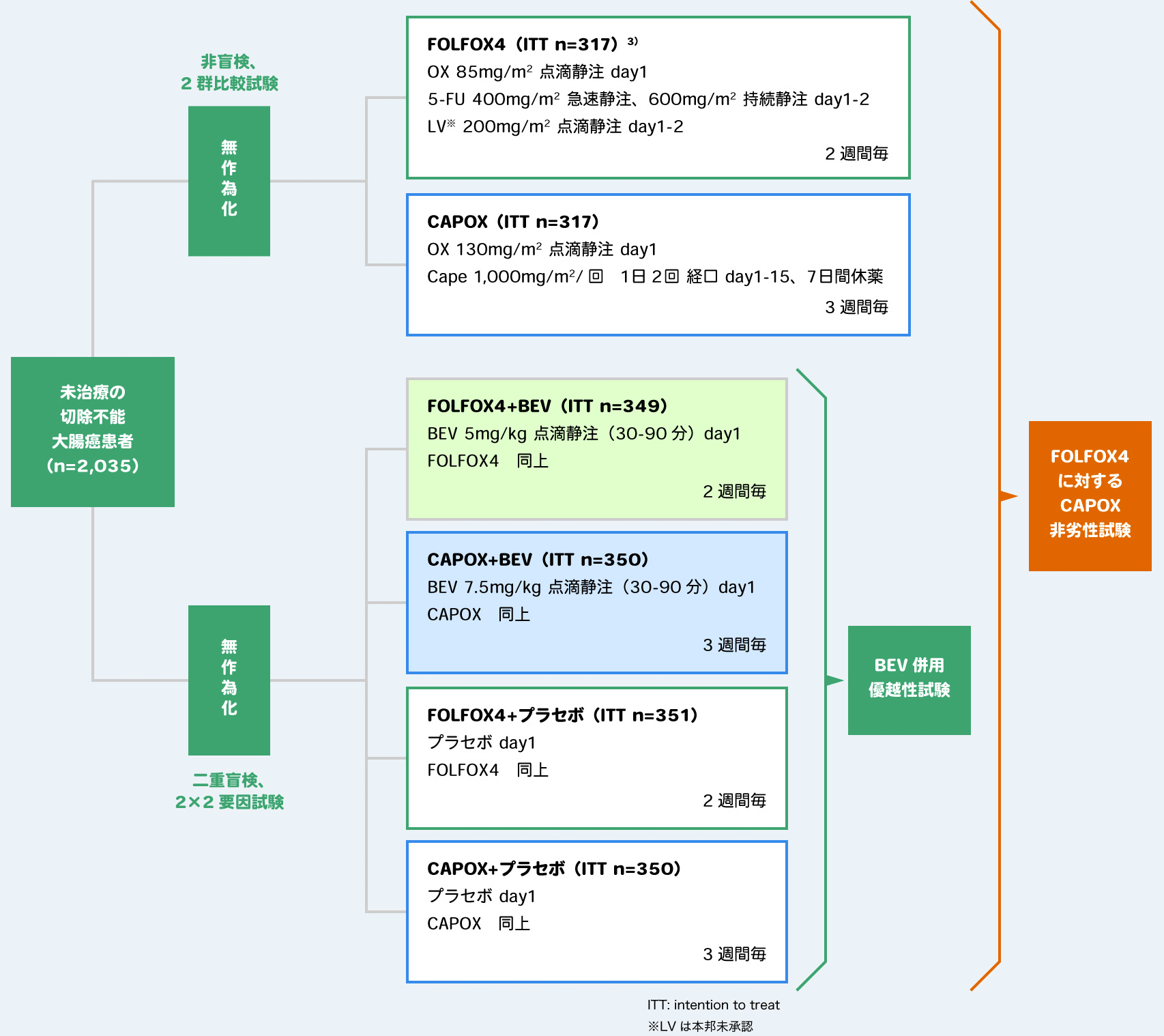
- Cassidy J, et al.: “Randomized Phase III Study of Capecitabine Plus Oxaliplatin Compared With Fluorouracil/Folinic Acid Plus Oxaliplatin As First-Line Therapy for Metastatic Colorectal Cancer”, J Clin Oncol. 2008; 26(12): 2006-2012.
- Saltz LB, et al.: “Bevacizumab in Combination With Oxaliplatin-Based Chemotherapy As First-Line Therapy in Metastatic Colorectal Cancer: A Randomized Phase III Study”, J Clin Oncol. 2008; 26(12): 2013-2019.
- de Gramont A, et al.: “Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer”,J Clin Oncol. 2000; 18(16): 2938-2947.
FOLFOX+BEV併用療法における
服薬指導時の注意点
FOLFOX+BEV併用療法では、神経障害と悪心、嘔吐、下痢、口内炎などの消化器症状が多く発現しています。
神経障害の中でも特に末梢神経障害の症状として足の痺れや疼痛、感覚異常を確認してください。OXは蓄積性の末梢神経障害があることが知られていますので、治療コースを繰り返す場合には注意が必要となります。OXによる末梢神経障害は冷感刺激により誘発されますので、患者さんには冷たい飲み物や氷の使用を避ける、冷房が肌に直接当たるのを避けるなどの予防法を伝えましょう。
悪心・嘔吐については、服薬指導の際に下痢や嘔吐の回数、食事への影響などを聴取し、脱水を起こさないように指導してください。強い腹痛がある場合は、消化管穿孔のおそれがありますので、痛み止めなどを安易に服用せずに主治医や薬剤師に連絡するように指導してください。
口内炎になると痛みにより食事や水分の摂取が困難になる場合があります。歯磨きやうがいで口腔内を清潔に保ち、粘膜の乾燥を防ぐために適度な水分補給をするよう指導してください。
BEVに特徴的な副作用として、高血圧、蛋白尿、血栓塞栓症、出血、消化管穿孔、創傷治癒遅延などがみられます。また、重篤な副作用として好中球減少症が認められる場合があります。自覚症状はありませんが、服薬指導の際には、感染予防を心がけるように注意喚起してください。
CAPOX+BEV併用療法
CAPOXは、FOLFOXの5-FU、l-LVを経口抗癌薬であるカペシタビン(Cape)に置き換えたもので、XELOX、CapeOXとも呼ばれます。当院では、このCAPOXにBEVを加えたレジメンもよく使用します(表4)。基本的に当院では点滴は外来で行い、カペシタビンは院外処方箋を発行しています。
表4 当院のCAPOX+BEVレジメン
(1コース:21日)
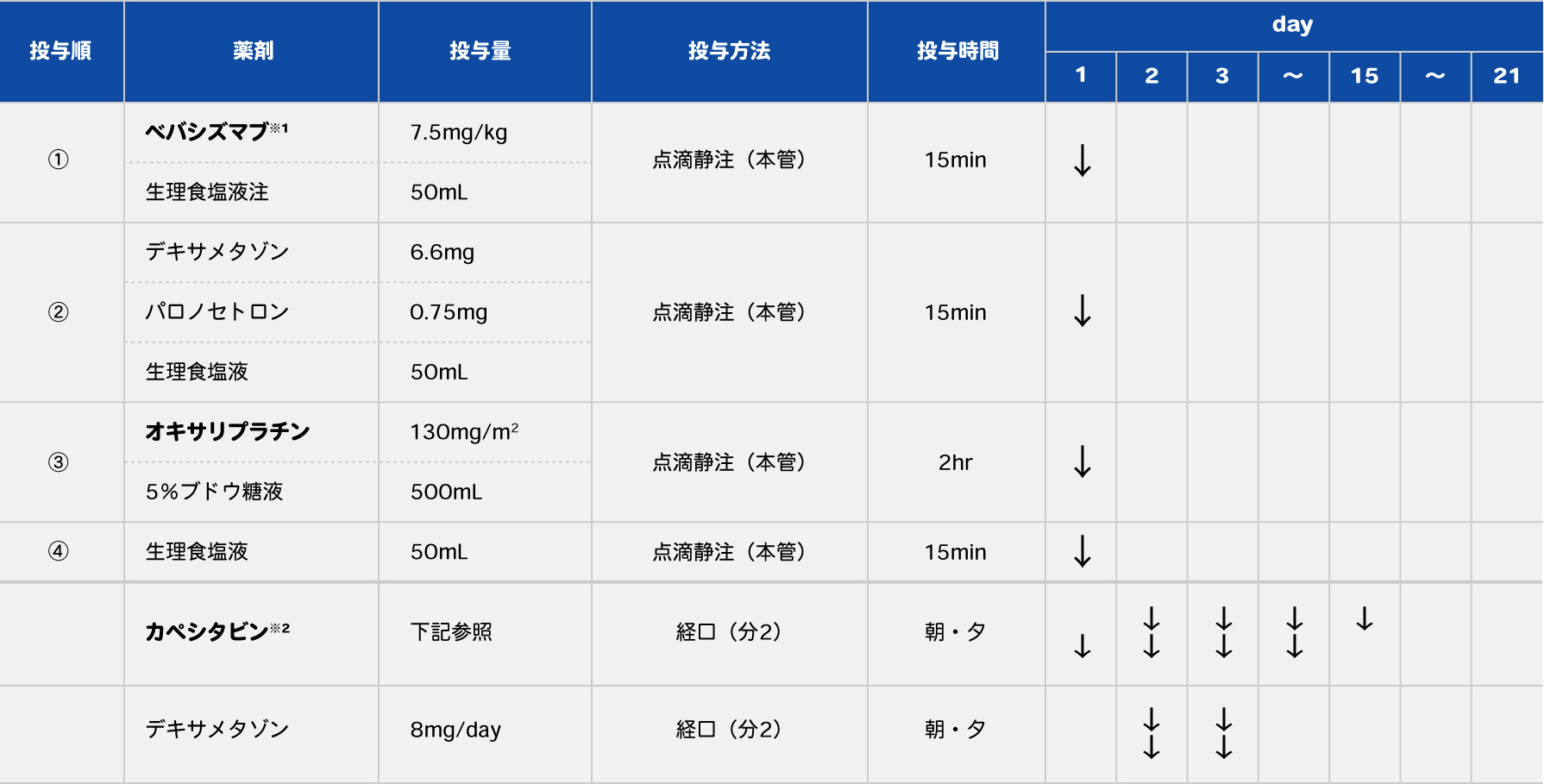
- ※1 ベバシズマブの投与時間については、Reidy DL, et al.: J Clin Oncol. 2007; 25(19): 2691-2695の試験結果をもとに決定した。本邦で承認されたベバシズマブの投与時間については各薬剤の添付文書を参照。
- ※2 カペシタビンの投与量は以下のとおり。

カペシタビンとオキサリプラチンは、副作用の重症度に応じて休薬し、治療再開時には下記のように段階的に減量した投与量を用います(表5)。カペシタビンの投与量は、体表面積に応じて表6のように異なります。
表5 CAPOX減量基準

オキサリプラチン点滴静注液50mg・100mg・200mg「NIG」およびカペシタビン錠300mg「日医工」添付文書より作成
表6 カペシタビンの減量時の投与量※
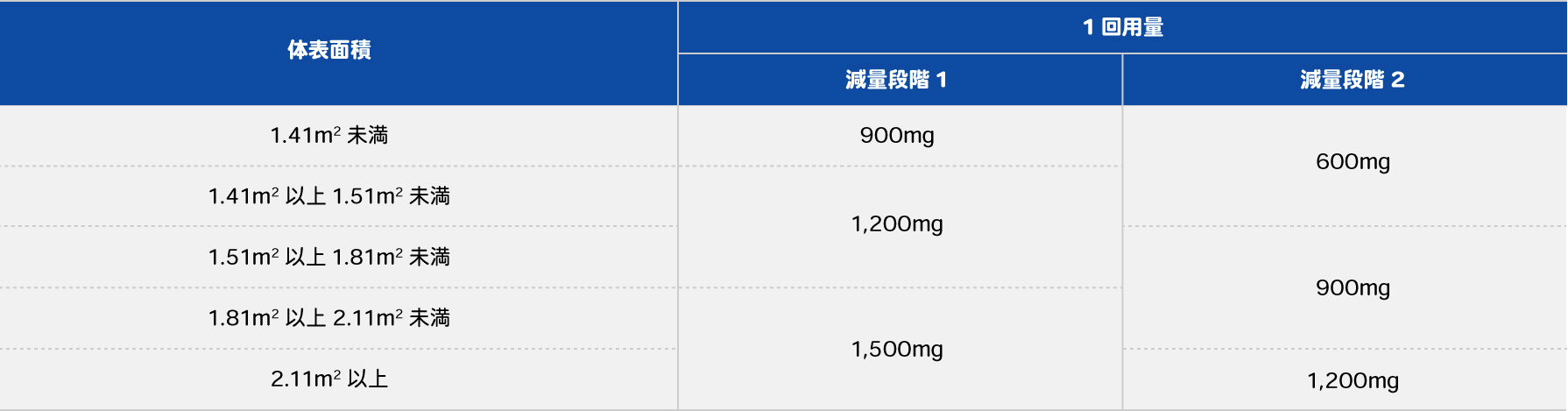
- ※体表面積当たりの用量1,000mg/m2相当量で投与開始の場合
カペシタビン錠300mg「日医工」添付文書より作成
CAPOX+BEV併用療法の臨床試験
前述のとおり、CAPOX+BEV併用の有用性の根拠となる臨床試験はFOLFOX+BEVと同じNO16966試験(臨床試験①)です。CAPOX単独での有用性については、同試験のFOLFOX4に対する非劣性試験で確認されています1)。
非劣性試験の主要評価項目であるPFS中央値は、CAPOX群が8.0ヵ月、FOLFOX4群が8.5ヵ月であり(HR 1.04、97.5%CI 0.93-1.16) 、事前に設定した非劣性マージンの上限1.23内であったため、CAPOXのFOLFOX4に対する非劣性が示されました。本試験において、治験薬投与中止に至った有害事象は、FOLFOX4群(FOLFOX4±プラセボ)649例中161例(25%)、CAPOX群(CAPOX±プラセボ)655例中170例(26%)で認められました。最終投与から28日以内に認められた治療関連死はFOLFOX4群で11例(1.7%)、CAPOX群で14例(2.1%)で認められました。主な有害事象は、悪心、下痢、手足症候群などでした1)。
FOLFOXと同様にフォローアップ後の解析によるCAPOX+BEV群の有害事象を表7に示します2)。 神経障害、下痢、悪心、嘔吐が多いのは、FOLFOX4+BEV群と同様ですが、FOLFOX4と比べてGrade3以上の下痢や手足症候群が多いことが特徴です。
- Cassidy J, et al.: J Clin Oncol. 2008; 26(12): 2006-2012.
- Cassidy J, et al.: Br J Cancer. 2011; 105(1): 58-64.
表7 CAPOX+BEV群の有害事象(n=353)
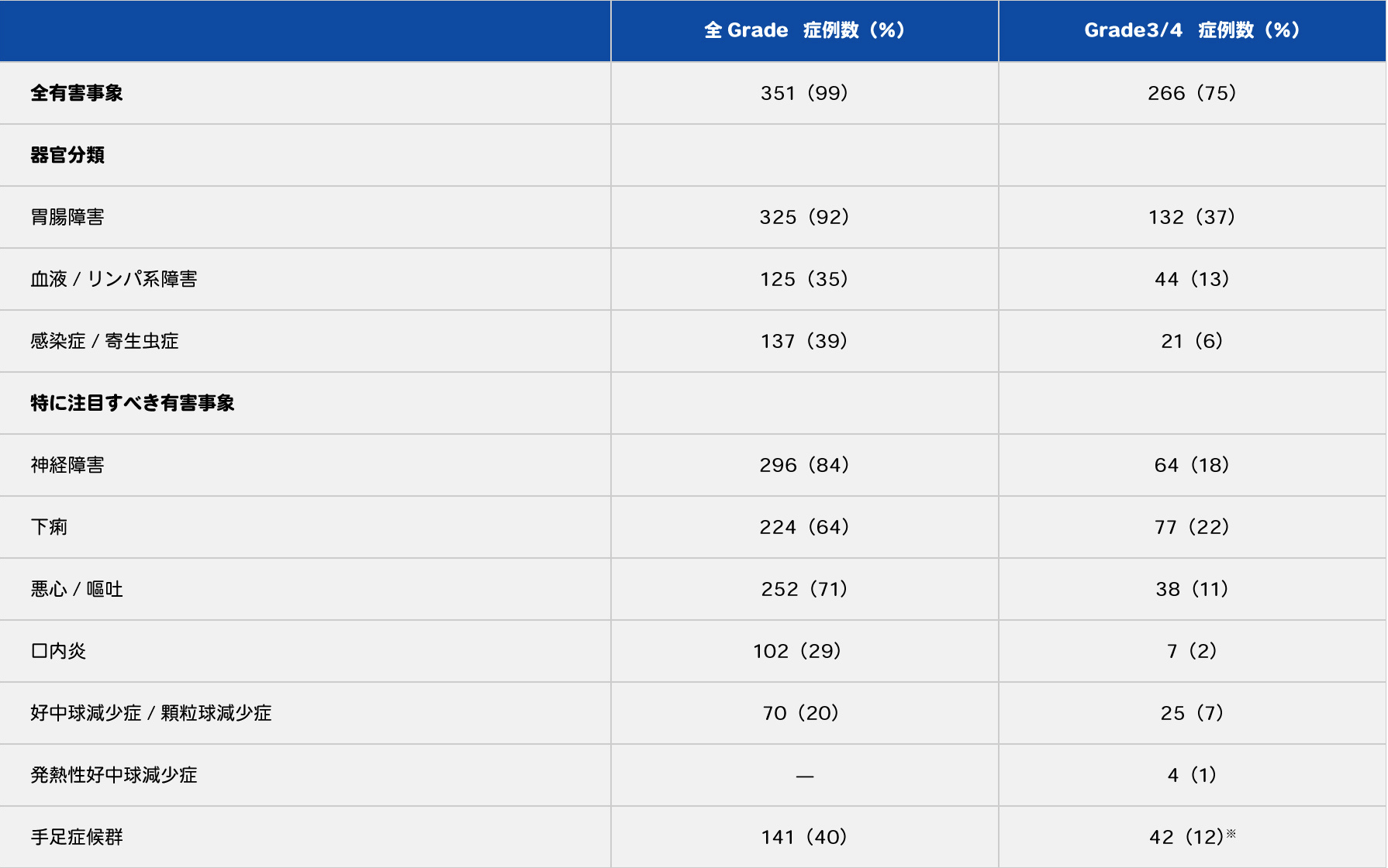
- ※Grade3のみ
Cassidy J, et al.: Br J Cancer. 2011; 105(1): 58-64より許可を得て転載
CAPOX+BEV併用療法における
服薬指導時の注意点
CAPOX+BEV併用療法で用いられるカペシタビンは、5-FUと同じフッ化ピリミジン系抗癌薬の経口剤であり、5-FUの持続静注が不要となるため、中心静脈ポート(CVポート)の留置が不要で患者さんの負担が軽減されるなどの利点があります。一方で、患者さん自身が服薬管理を行うため、アドヒアランスを良好に維持することが重要です。過剰に服薬してしまうと致死的な状態に陥る場合もありますので、患者さんが休薬期間など服薬方法を理解しているか必ず確認をしてください。
またカペシタビンに多くみられる副作用として手足症候群があります。手足症候群では、手のひらや足裏の感覚が鈍くなる、過敏になる、ヒリヒリ・チクチクする、赤く腫れる、皮膚にひび割れや水ぶくれが生じ痛みが出る、色素沈着や爪の変色・変形が起こるなどの症状がみられます。手足症候群は致命的な副作用ではありませんが、患者さんのQOL低下に影響します。保湿剤などを使用し予防に努めながら、手足の痺れや感覚異常、ヒリヒリした痛みなどの初期症状がないか服薬指導時に確認をしてください。
FOLFIRI+BEV併用療法
FOLFIRIは、FOLFOXのOXをイリノテカン(IRI)に置き換えたものです。一次治療でどちらのレジメンを選択するかはOXとIRIの副作用の忍容性で決定されます。具体的にはOXによる末梢神経障害などの副作用が問題となる場合はFOLFIRIを選択します。
FOLFIRIにBEVを併用する当院のレジメンを表8に示します。このレジメンも当院では基本的に外来で薬物療法を行います。
FOLFIRIは、血液毒性や下痢などの副作用の重症度に応じて減量します。例として、海外での報告1)に基づいた減量基準を示します(表9)。
- Tournigand C, et al.: J Clin Oncol. 2004; 22(2): 229-237.
表8 当院のFOLFIRI+BEVレジメン
(1コース:14日)
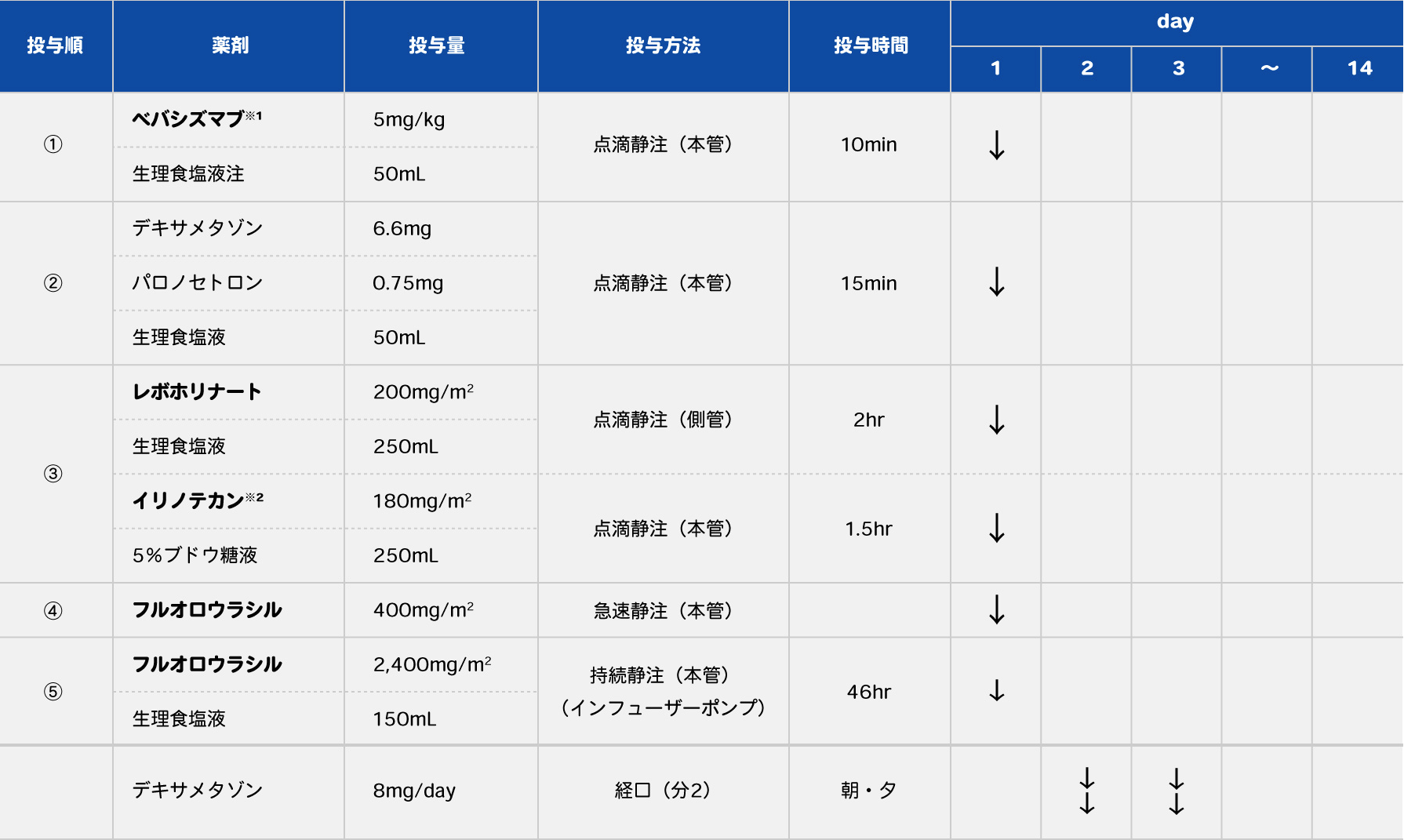
- ※1 ベバシズマブの投与時間については、Reidy DL, et al.: J Clin Oncol. 2007; 25(19): 2691-2695の試験結果をもとに決定した。本邦で承認されたベバシズマブの投与時間については各薬剤の添付文書を参照。
- ※2 イリノテカンの投与量については、NCCN腫瘍学臨床診療ガイドライン2017など海外のガイドラインで標準とされている180mg投与を採用している。本邦で承認されたイリノテカンの投与量については各薬剤の添付文書を参照。
表9 FOLFIRI減量基準

Tournigand C, et al.: J Clin Oncol. 2004; 22(2): 229-237より作成
FOLFIRI+BEV併用療法の臨床試験
「大腸癌治療ガイドライン 医師用2022年版」では、FOLFIRI+BEV併用の有用性の根拠として臨床試験②1)およびイリノテカンを含む3種類の薬物療法、FOLFIRI、mIFL、CapeIRIとBEVを併用した場合の有効性と安全性を検討した臨床試験2)(CapeIRI+BEVは安全性の懸念から試験は実施されていない)があげられています。
臨床試験②は、本邦で実施された第Ⅲ相臨床試験(WJOG4407G試験)であり、切除不能な大腸癌に対する一次治療として、FOLFIRI+BEVのmFOLFOX6+BEVに対する非劣性を評価しました1)。
本試験では、PFS中央値を主要評価項目として非劣性を評価しました。その結果、PFS中央値は、FOLFIRI+BEV群で12.1ヵ月、 mFOLFOX6+BEV群で10.7ヵ月(HR 0.905, 95%CI 0.723-1.133)で、HRが事前に設定された非劣性マージン1.25内であったため、mFOLFOX6+BEV療法に対するFOLFIRI+BEV療法の非劣性が示されました。
本試験では、FOLFIRI+BEV群で30/195例(15%)、mFOLFOX6+BEV群で14/198例(7%)にGrade4の好中球減少症が認められました。FOLFIRI+BEV群の有害事象を表10に示します。 FOLFIRI+BEV群では、悪心、嘔吐、下痢などの消化器症状に加えて、Grade3以上の好中球減少症、白血球減少症、静脈血栓塞栓症、Grade1,2の脱毛の割合がmFOLFOX6+BEV群より多く認められました。また、FOLFIRI+BEV群では死亡が1例報告され、消化管穿孔によるものでした。
- Yamazaki K, et al.: Ann Oncol. 2016; 27(8): 1539-1546.
- Fuchs CS, et al.: J Clin Oncol. 2007; 25(30): 4779-4786.
表10 FOLFIRI+BEV群の有害事象(n=195)
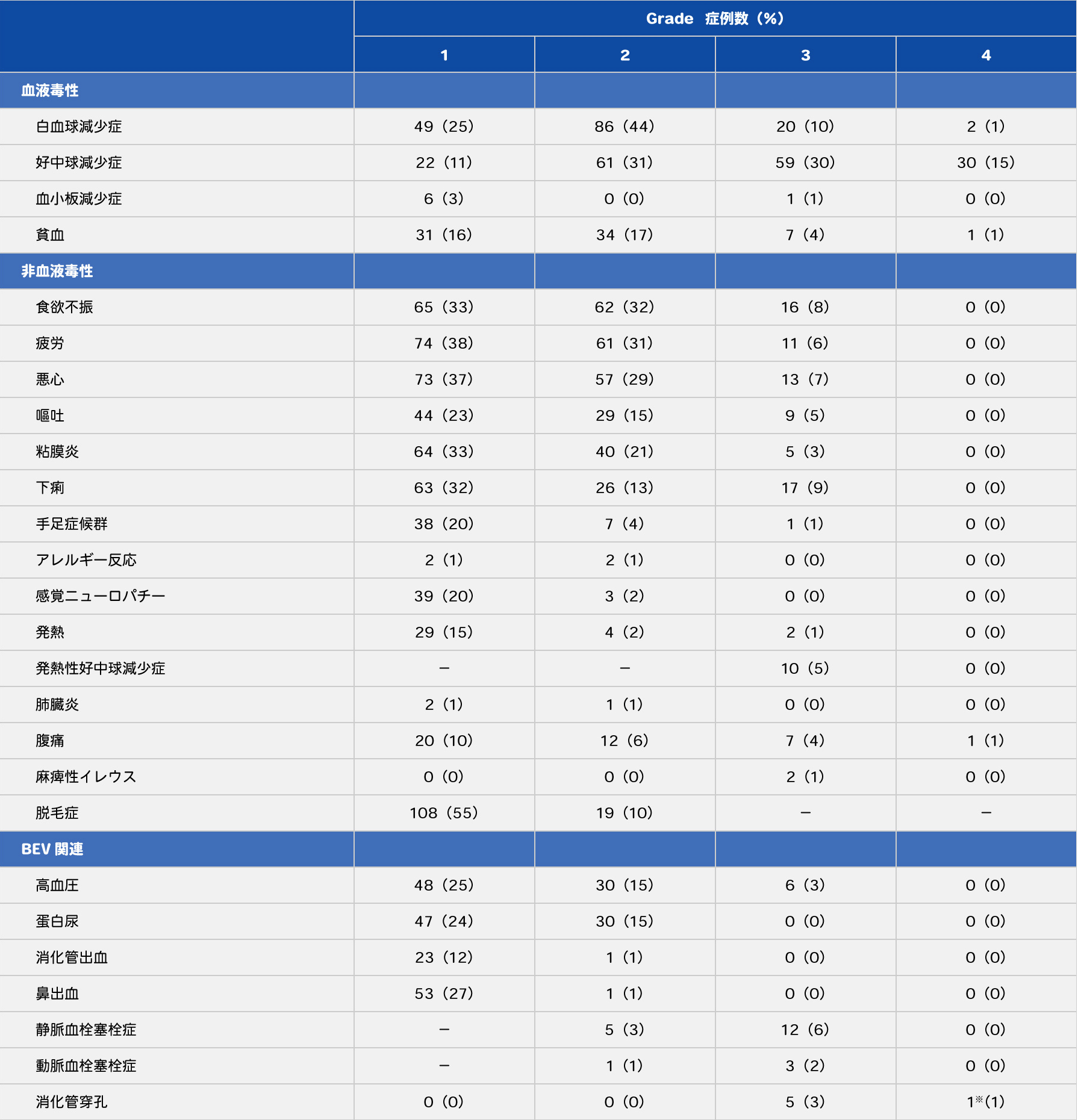
- ※消化管穿孔1例はGrade5(死亡)
Yamazaki K, et al.: Ann Oncol. 2016; 27(8): 1539-1546より許可を得て転載
臨床試験❷ 試験概要
目的・対象:本試験(WJOG4407G試験1))は未治療の切除不能大腸癌患者402例を対象としFOLFIRI+BEVのmFOLFOX6+BEVに対する非劣性や各療法の長期QOLなどを評価した。
方法・試験デザイン:対象患者402例を無作為化し、FOLFIRI+BEV群、mFOLFOX6+BEV群に1:1に割り付けた非盲検2群比較試験。各群の投与は下図のように実施し、主要評価項目としてPFSを評価した。
解析計画:HRはCOX比例ハザードモデルを用い、施設、術後補助療法の有無、多臓器への転移の有無を因子として調整した。主要評価項目であるPFSのHRの95%CI上限値が事前に設定した非劣性マージン1.25を下回れば、非劣性が証明されることとした。
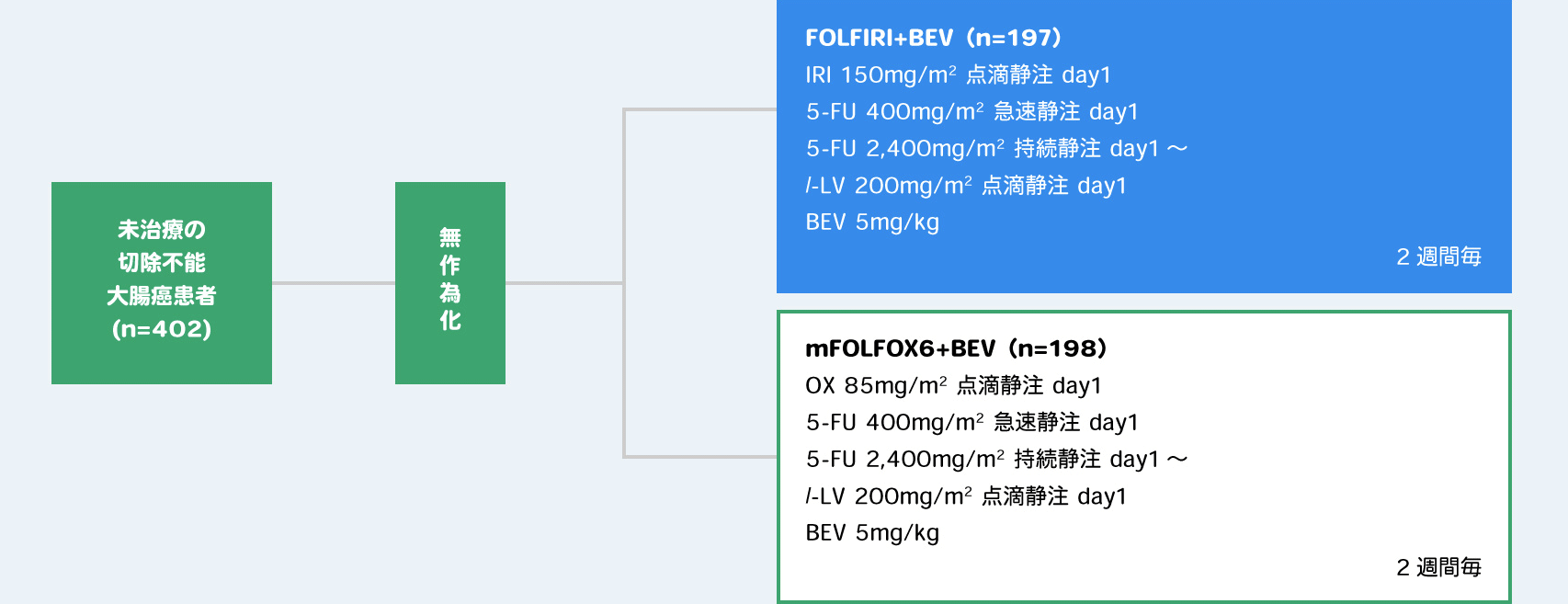
- Yamazaki K, et al.: “Randomized phase III study of bevacizumab plus FOLFIRI and bevacizumab plus mFOLFOX6 as first-line treatment for patients with metastatic colorectal cancer(WJOG4407G)”, Ann Oncol. 2016; 27(8): 1539-1546.
FOLFIRI+BEV併用療法における
服薬指導時の注意点
FOLFIRI+BEV併用療法では、下痢、悪心、嘔吐などの消化器症状と好中球減少症の副作用が多く発現しています。水溶性の下痢が認められたときには、脱水を防ぐために十分な水分摂取が必要です。発熱や好中球減少症を伴う下痢では、感染性腸炎の合併にも注意が必要です。止痢薬として、ロペラミドが処方される場合もあります。
また、FOLFIRIで用いられるイリノテカンの副作用の特徴として脱毛があげられます。脱毛の程度は使用する薬剤の種類や量によって異なり、個人差もあります。服薬指導の際には、治療開始後2〜3週間で脱毛が起こること、その間に帽子やカツラの準備をしておくこと、脱毛が目立たなくなる工夫などを説明してください。治療が終了すれば1〜2ヵ月で発毛してくることも併せて伝えましょう。
薬剤師の皆さんへ

Vol. 2では、切除不能進行・再発大腸癌の一次治療で適応される薬物療法を三つ取り上げました。三つのレジメンの使い分けとして、例えば家庭での服薬管理が困難な方であれば、外来ですべての抗癌薬を投与するFOLFOX+BEV、FOLFIRI+BEVが、服薬管理が可能でインフューザーポンプの留置を避けたいならば経口の抗癌薬を用いるCAPOX+BEVが選択されるケースがあります。
また、副作用の観点からは、外見的な変化が大きい脱毛が気になる患者さんにはFOLFIRI+BEVを避けたり、手足の指先の感覚が鈍ってしまう末梢神経障害がQOLに大きな影響を与えてしまう患者さんにはFOLFOX+BEV、CAPOX+BEVを避けるなど、治療法の選択には患者さんの心理的負担や生活・社会環境への影響も考慮されます。Vol. 1でも述べたように、この他にも多くの選択肢があり、患者さんの状態によって治療法を選択しています。
オキサリプラチン、イリノテカンは中等度の催吐性リスクを持つ薬剤であるため1)、実際に病院で使用するレジメンでは、デキサメタゾン、パロノセトロンなどを中心に必要に応じてアプレピタントなどの制吐薬を組み合わせて用います。支持療法については、本Webサイト掲載の「診療現場最前線」も併せてご覧ください。
各病院で用いられているレジメンについては、病院のホームページから閲覧できる場合が多いので、確認してみましょう。
Vol. 1でもお伝えしましたが、薬剤師の皆さんが各疾患の基本的な治療方針を理解することはとても重要です。治療方針を知ることで、注意すべき副作用を想定しながら服薬指導にあたることができます。今回のVol. 2で紹介した三つのレジメンの服薬指導時の注意点をもう一度見返していただき、レジメンからどのような副作用に注意して服薬指導、観察を行っていけばよいか整理するとよいでしょう。
ぜひ、この「薬剤師のためのBasic Evidence」を患者指導に役立ててください。
- 日本癌治療学会: 「制吐薬適正使用ガイドライン」2015年10月【第2版】一部改訂版 ver.2.2(2018年10月)
http://www.jsco-cpg.jp/item/29/index.html(2022年5月閲覧)
当コンテンツの情報および監修者の所属・役職は掲載日時点での情報となります。
また、当該医薬品の使用に当たっては、最新の添付文書、ガイドライン等をあわせてご参照くださいますようお願いします。
