抗菌薬適正使用チーム(AST)の現状と課題

昭和医科大学薬学部 臨床薬学講座
感染制御薬学部門
准教授 前田 真之 先生
抗菌薬適正使用支援チーム(AST:Antimicrobial Stewardship Team)は抗菌薬の適切な使用を推進することで、耐性菌の出現抑制と患者の治療効果の最大化を両立させる重要な医療チームです。米国で体系化された仕組みですが、日本では感染症の専門家不足という独自の課題を抱えながら発展してきました。vol.6では、ASTの基本概念から実践まで、特に日本の医療現場における課題に焦点を当て、その解決に向けた具体的な取り組みについて解説します。
目次
- ASTの起源と基本的な概念
- 日本のASTの現状と課題
- より持続的なAST運営のための取り組み
- アンチバイオグラムの活用による初期治療の最適化
- 昭和医科大学病院におけるASTの取り組みとDASC指標の導入
- AST成功のための戦略的なアプローチ
- 抗菌薬使用の4つのタイミング
ASTの起源と基本的な概念
ASTの体系的な活動を最初に推奨したのは、米国感染症学会(IDSA:Infectious Diseases Society of America)と米国医療疫学学会(SHEA:The Society for Healthcare Epidemiology of America)が2007年に発表したガイドライン1)です。このガイドラインでは、ASTが取り組むべき2大戦略として、①抗菌薬の事前承認と②抗菌薬使用後のモニタリングと主治医へのフィードバックが提示されています1)。これらの戦略を含むASTの取り組みは抗菌薬適正使用支援プログラム(ASPs:antimicrobial stewardship programs)と呼ばれます。
ASTは、感染症専門医と感染症のトレーニングを受けた臨床薬剤師の2名を中心に、臨床検査技師や看護師などを加えた組織とすることが提案されています。通常、医療チームのリーダーは医師が務めることが多く、ASTにおいても専門医がリーダーとなりチームの取り組みや結果に対して責任を持ちますが、共同リーダーとして薬剤師を指名して実質的なASPsの構築と運用を担当します。薬剤師が主導で抗菌薬適正使用の介入を行った場合、若手の感染症医が行うよりも効果的であるというデータや、感染症専門医が不在の施設でも薬剤師の介入で成果が上がるとする報告が示されたこともあり2)、薬剤師はASTにおいて非常に重要な位置づけとなっています。
日本のASTの現状と課題
日本では基本的に感染症専門医の数が少なく、専門医が不在の医療機関では、薬剤師がASTのリーダー的役割を担い、主導的に活動しているケースが多く見受けられます。しかし、専門医が不在のチームの場合、処方医に対して抗菌薬の選択変更や使用方法の改善を促すことが難しいという問題があります。このコミュニケーションの壁は、ASTの効果的な運営を妨げる要因の一つとなっています。
コミュニケーションの壁がある理由の1つとして、抗菌薬使用における主治医とASTの本質的な視点の相違が挙げられます。主治医は個々の患者にとっての最適な治療、すなわち個人の利益を重視する一方、ASTは抗菌薬使用の適正化による耐性菌対策という公衆衛生的な視点、すなわち集団の利益を重視した活動になっている場合があります。この視点の違いは、対立を生じ、容易に解決できないジレンマとなります。
このジレンマを解決するためには、ASTが患者を治すという視点に立って1つ1つの症例を丁寧に検討し、主治医により良い選択肢を提案しながら、不必要な抗菌薬使用を減らす努力を継続することが必要です。しかし、この個別的なアプローチは重要ですが、持続的に行うのは困難を伴うかもしれません。
より持続的なAST運営のための取り組み
持続的な解決策としては、システマティックな仕組みづくりを進めることが望ましいと考えられます。例えば、抗菌薬の届出制または許可制の導入や特定患者群への診療支援体制の確立、さらには明確な病院内ポリシーや抗菌薬使用ガイドライン・マニュアルの策定とそれに基づく標準化された運用などです。
特に抗菌薬の届出制及び許可制は、感染防止対策加算の要件として導入されたことを契機に、日本全国で急速に普及しました。この制度は広域抗菌薬の安易な使用を抑制する目的で、感染症への適応を再確認し、使用理由を明確化するための仕組みとして設計されています。しかし、届出用紙の提出やカルテシステムでのアラート確認といった形式的な手続きのみで承認される仕組みは、容易に形骸化してしまうことが指摘されています。そこで、日本化学療法学会をはじめとする関連学会は「抗菌薬適正使用支援プログラム実践のためのガイダンス」3)において、ASTが届出後の抗菌薬使用状況を継続的にモニタリングし、主治医への介入やフィードバックを組み合わせた包括的なアプローチを行うことを推奨しています。これにより、形式的な手続きに終わることなく、実質的な抗菌薬適正使用の促進を目指しています。
アンチバイオグラムの活用による初期治療の最適化
自施設における細菌の抗菌薬感受性パターンや有効性の確率を示すアンチバイオグラムは、感染症治療において極めて重要な役割を果たします。アンチバイオグラムの最大の意義は、原因菌の薬剤感受性が判明する前の段階、すなわちエンピリックセラピー(経験的治療)時に適切な抗菌薬選択を可能にすることです。主治医がより適切な初期治療を行えるよう、アンチバイオグラムの適切な理解と活用を推進することもASTの重要な役割の1つです
昭和医科大学病院におけるASTの取り組みとDASC指標の導入
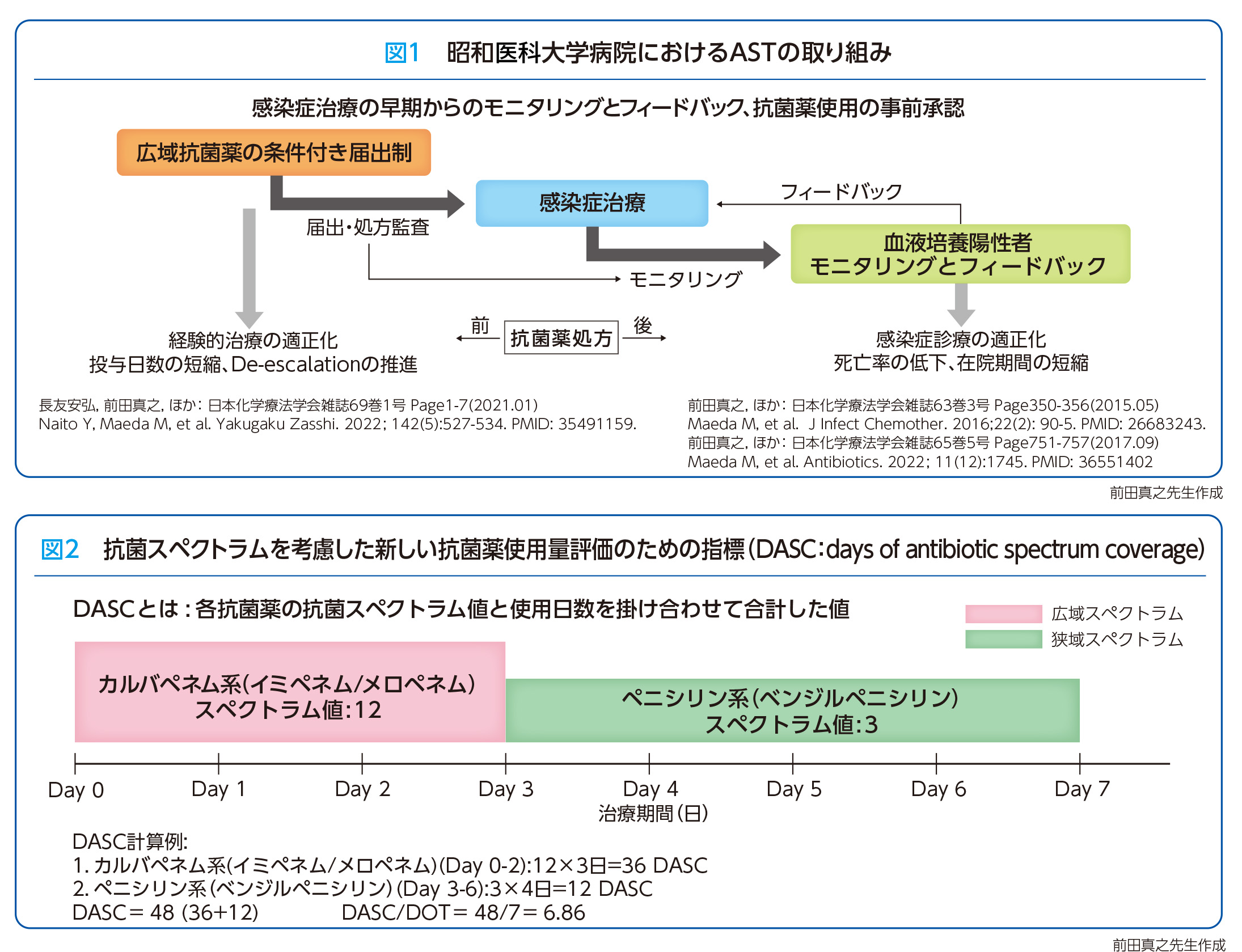
昭和医科大学病院では、長年、ASTによる様々な取り組みを行い、その効果を定量的に評価し、改善効果を検証してきました(図1)。特に、広域抗菌薬の使用を減らすためにデ・エスカレーションの戦略を重視しています。これは、広域抗菌薬を使用した後、原因菌や感受性が判明した段階で狭域抗菌薬に切り替える方法です。医師に対して「なぜ広域抗菌薬を使用しているのか」「原因菌がわかったので変更してほしい」と連絡したり、長期投与の終了を促すなどの働きかけを続けています。処方の動向を追跡して評価するために、カルバペネム系抗菌薬を使用したケースを個別に分析するといったことも行っています。
こうした中、抗菌スペクトラムを考慮した新しい抗菌薬使用量の評価指標(DASC:days of antibiotic spectrum coverage)が開発されました。DASCは、カルバペネム系抗菌薬のイミぺネムやメロペネムは12、ペニシリン系抗菌薬のベンジルペニシリンは3といったように薬剤ごとの抗菌スペクトラムの広さを数値化し、スペクトラムスコア×投与日数という計算式を用いることで抗菌薬の使用状況を評価します(図2)。広範囲の細菌に効果を示す抗菌薬ほど高い値を示し、狭い範囲の抗菌薬では低い値となる仕組みで、抗菌スペクトラムを可視化できます。この指標は、広域スペクトラム抗菌薬の過剰使用を抑制し、耐性菌の発生リスクを低減する効果が期待されています。また、施設間の比較を行うことにより、地域や全国規模での適正使用推進にも役立ちます。DASCは抗菌薬使用の「量」だけでなく「質」を評価する指標として、感染症治療や耐性菌対策に大きく貢献する可能性を秘めています。
AST成功のための戦略的なアプローチ
多くの医療施設における抗菌薬適正使用の最大の課題は、自施設固有の問題点を適切に把握できていない点にあります。国のアクションプランに従って抗菌薬使用量を減らすことや4)、経口の第3世代セファロスポリン系抗菌薬の使用制限を行うことは重要ですが、これらは手段であって目的ではありません。効果的なASPの確立には、以下のステップが不可欠です。
まず、自施設の現状分析から始める必要があります。抗菌薬使用量や耐性菌の発生状況などのモニタリングを通じて、具体的な問題点を特定します。同時に、感染症診療における質の向上という観点も重要ですから、例えば、カンジダ血流感染症における血液培養の陰性確認、適切な抗真菌薬の選択、眼内炎のスクリーニングなど、疾患特異的な診療バンドルの遵守状況も確認していく必要があります。そして、問題点を特定した上で、具体的な改善策を立案・実施し、その効果を評価して次の対策に活かすPDCAサイクルを回していくことが求められます。つまり、抗菌薬適正使用の成功には、漠然とした目標設定ではなく、自施設の具体的な課題に基づいた戦略的なアプローチが不可欠なのです。
抗菌薬使用の4つのタイミング
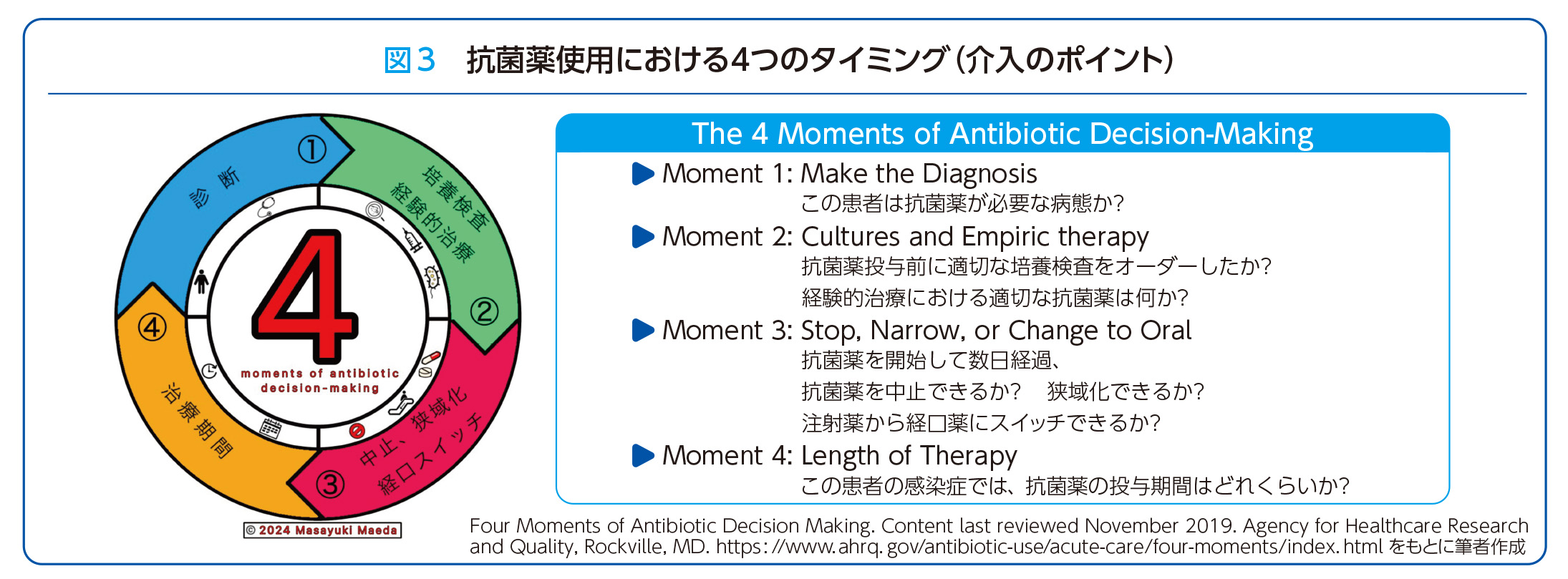
感染対策においてWHOの「手指衛生の5つのタイミング」が広く普及しているように、2019年には抗菌薬適正使用においても「抗菌薬使用における4つのタイミング」が米国の医療研究・品質調査機構によって提唱されました5)。この枠組みは、抗菌薬使用における重要な判断ポイントを体系化したものです。①まず適切な診断を確立し、②培養検査を実施するとともに診断に基づいて経験的治療を開始します。③その後、治療経過に応じて抗菌薬使用の最適化を図り、必要に応じて投与中止や狭域化、経口薬への切り替えを検討します。④そして最後に、感染症の病態に応じた適切な治療期間を設定します(図3)。
この4つのタイミングは、感染症診療の基本原則を反映しており、ASTの介入ポイントとしても有用です。さらに重要な点は、この枠組みが最終的に主治医の自律的な判断を促す教育ツールとしても機能することです。手指衛生のキャンペーンと同様に、この概念を抗菌薬届出制の運用と組み合わせて活用することで、より体系的な抗菌薬適正使用の実現が期待できます。
1)DellitTH, et al. Clin Infect Dis. 2007; 44(2): 159-177.
2)Waters CD, et al. Am J Health Syst Pharm. 2015; 72(6): 466-468.
3)8学会合同抗微生物薬適正使用推進検討委員会. 日化療会誌. 2017; 65(5): 650-687.
4)厚生労働省 : 薬剤耐性(AMR)対策アクションプラン(2023-2027)
令和5年4月7日国際的な脅威となる感染症対策の強化のための国際連携等関係閣僚会議
https://www.mhlw.go.jp/content/10900000/ap_honbun.pd(2024年11月閲覧)
5)Four Moments of Antibiotic Decision Making. Content last reviewed November 2019. Agency for Healthcare Research and Quality, Rockville, MD.
https://www.ahrq.gov/antibiotic-use/acute-care/four-moments/index.html
6)Maeda M, et al. Antibiotics. 2022; 11(12): 1745.
DASCとは
DASCは米国から報告されましたが、長崎大学の柿内聡志先生が開発に貢献しています。当院でもいち早く導入し、私自身も日本でいち早くDASCを用いた評価研究を行い、論文を発表しています6)。論文ではDASCの指標の有用性を検証するために、2年間にわたり血流感染症(BSI)患者の抗菌薬使用実態を調査しました。血液培養陽性の入院患者1,443例(汚染疑い265例を含む)を対象に分析しました。
分析の結果、患者一人当たりの累積抗菌薬スペクトル日数(DASC)と抗菌薬投与日数(DOT)における毎月の測定値には強い正の相関が認められました。一方で、DASC/DOT比はDASCやDOTなどの投与日数や抗菌薬のカバー範囲を示す測定値との相関を示しませんでした。このことより、DASC/DOT比は独立した評価指標として機能することが示唆されました。
この結果から、DASC/DOT比は、血流感染症における抗菌薬選択の適切性を評価する指標となりうることが示唆されました。具体的には、DASC/DOT比が高い場合は、DOTに対して広域抗菌薬の使用が相対的に多いことを示し、逆にDASC/DOT比が低い場合は、狭域抗菌薬の使用が多いことを意味します。このような評価により、例えば広域抗菌薬の過剰使用や不適切な長期使用など、抗菌薬選択の問題点を客観的に特定することが可能となります。
現在、DASCを活用した取り組みと評価は日本国内のさまざまな病院に広がりつつあります。
